Федеральное государственное унитарное предприятие «государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства
Ежегодно регистрируется более 250 тысяч смертей от злокачественных новообразований в России и 8 миллионов в мире. Эффективность традиционных методов лечения, а также моноклональных антител и генной терапии лимитирована в случае резистентных форм и труднодоступной локализации опухоли.
Лактоферрин (лФ) является универсальным белком с противораковой активностью, модулирует иммунный ответ и систему окислительно-восстановительных реакций организма, отличается кроссвидовой биосовместимостью. Благодаря способности взаимодействовать не только со специфическими рецепторами, но и с сигнальными, эндоцитоза и TLR на различных типах клеток, лФ преодолевает гемотканевые барьеры. на моделях in vivo и in vitro подтверждена терапевтическая эффективность применения лактоферрина, продуктов его расщепления и синтетических пептидов при различных видах злокачественной пролиферации. В экспериментах продемонстрирована перспективность использования лФ как адьюванта перед химио- и радиотерапией, носителя при генной терапии рака. однако результаты клинических исследований малочисленны и требуют дальнейшего изучения. ключевые слова: обзор, лактоферрин, лактоферрицин, рак, терапия.
Согласно данным, приведенным в проекте национальной стратегии по борьбе с онкологическими заболеваниями на долгосрочный период до 2030 г., рост уровня первичной заболеваемости злокачественными новообразованиями в России за период 2006-2016 гг. составил 22,7%. ежегодно выявляется более полумиллиона случаев, на учете в онкологических диспансерах состоит 2,4% населения страны. В структуре смертности населения России злокачественные новообразования занимают второе место (около 15% случаев или четверть миллиона человек ежегодно). Данные ВоЗ аналогичны — второе место в структуре смертности (более 8 миллионов ежегодно), прогнозируется устойчивый рост заболеваемости.
Ведется активная разработка новых цитостатиков, создание моноклональных антител против опухолевых неоантигенов, онколитических вирусов [1], усовершенствование методов радиотерапии [2] и других способов лечения. Однако эффективность традиционного лечения лимитирована его неселективным воздействием на здоровые клетки, при этом триггерные механизмы развития заболевания многообразны, изучены не полностью и пока не поддаются профилактике, а труднодоступная локализация опухоли значительно ограничивает применение хирургического и консервативного лечения. Это обосновывает необходимость поиска универсальных терапевтических агентов, способных избирательно воздействовать на злокачествленные клетки, а также преодолевать биологические барьеры.
Лактоферрин (ЛФ) — универсальный регуляторный компонент иммунной системы млекопитающих, обладающий не только выраженной антибактериальной и противовирусной активностью, но и способностью подавлять развитие многих форм рака [3-5]. молекулярная масса данного гликопротеина с выраженными щелочными свойствами (изоэлектрическая точка 8-9) варьирует от 75-77 кДа у нативной апоформы до 80-82 кДа у связанной с ионами металлов холоформы [3, 6, 7]. Помимо металлов ЛФ способен взаимодействовать с гепарином, липополисахаридами, нуклеиновыми кислотами, гликозаминогликанами [6-8]. Специфические рецепторы к ЛФ экспрессированы на поверхности т- и В-лимфоцитов, макрофагов, нейтрофилов, дендритных и многих других клеток [6, 7]. Кроме того, ЛФ взаимодействует с TLR, рецепторами эндоцитоза (low-density lipoprotein receptor-related protein или LRP) и сигнальными рецепторами [8-10].
Лактоферрин синтезируется эпителиальными клетками, а также в значительном количестве депонирован в гранулах нейтрофилов. наибольшие концентрации ЛФ определяются в молозиве (5-7 мг/мл) и молоке (1-3 мг/мл). При воспалении, аллергии и беременности ЛФ активно высвобождается из нейтрофилов, его концентрация в крови увеличивается с 1 мкг/мл до 5-6 мкг/мл [6, 8]. Лактоферрин обнаруживается в слезной жидкости, слюне, бронхо-легочном лаваже, семинальной плазме, вагинальных секретах, синовиальной и спинномозговой жидкостях [6-8, 10].
Крайне важным с точки зрения перспектив терапии онкопатологии является сходство трехмерных структур и функций доменов ЛФ человека и млекопитающих: гомология аминокислотных последовательностей С-домена составляет от 72 до 96%. [11]. Известно, что пероральное применение ЛФ из молока коровы стимулирует повышение концентрации IgG и IgA в секретах [9]. наибольшее количество работ по влиянию на раковые клетки in vitro и in vivo посвящено изучению ЛФ именно из молока коровы (КЛФ) [3, 6, 10]. Значительным преимуществом является возможность перорального применения препаратов: через 10-20 минут ЛФ обнаруживается в печени, почках, селезенке и головном мозге мышей, лимфоузлах кишечника, что свидетельствует о сохранении структуры белка [12]. на сегодняшний день лактоферрин представлен в открытой продаже в виде БаДов из молока млекопитающих, включая трансгенных животных, а также растительных генномодифицированных продуктов [10, 13]. Проводятся эксперименты по получению рекомбинантного ЛФ, однако не всегда воспроизводится и учитывается степень гликозилированности белка, способная повлиять на его противораковую активность [14].
Воздействие ЛФ на развитие онкопролиферации может реализоваться при помощи различных механизмов. Данный белок модулирует реакции кислородного взрыва (в том числе образование супероксидных радикалов) и окислительного стресса, обладает свойствами антиоксиданта, блокирует перекисное окисление липидов [6, 9, 15-18].
Известно, что развитие онкопатологии сопровождается нарушениями гликозилирования белков, в том числе экспрессирующихся на цитоплазматической мембране злокачественных клеток. Являясь высокозаряженным катионитом, ЛФ (особенно связанная с железом форма) активно взаимодействует с фосфатидилсерином, сиаловыми кислотами гликопротеинов, гепаран-сульфатом протеогликанов раковых клеток, приводя к повреждению их цитоплазматических мембран, нарушению проницаемости мембран митохондрий и лизису трансформированных клеток за счет электростатических взаимодействий [18-20].
Кроме того, ЛФ является иммуномодулятором: повышает активность NK-клеток, фагоцитарную активность нейтрофилов [7,9,21], оказывает разнонаправленное воздействие на макрофаги и клетки Лангерганса, т- и В-лимфоциты (активация, созревание, миграция), меняет соотношение Th1/Th2 клеток, усиливает инфильтрацию опухоли лимфоцитами [15, 21]. ЛФ модулирует синтез цитокинов [5, 7, 10, 21], конкурирует с ИЛ-8 за сайты связывания протеогликанов [7, 15], способен непосредственно проникать в ядро клетки, с последующей стимуляцией синтеза IL-6 [7, 15]. описано супрессирующее воздействие ЛФ на VEGF- и bFGF-индуцированный ангиогенез, способствующий росту опухоли, на фоне активации синтеза ИФнγ и IL-18, подавляющих пролиферацию раковых клеток [22]. Установлено, что ЛФ, продукты его расщепления и синтезированные на основе его структуры пептиды подавляют пролиферацию и блокируют инвазию клеток опухоли, провоцируют развитие их некроза, индуцируют апоптоз через активацию системы каспаз.
Лактоферрин и его производные воздействуют на ат Фазы, снижают активность фосфорилирования, в том числе Akt и митоген-активируемых протеинкиназ, влияют на разнообразные регуляторные факторы, включая p21, p19, p27, Cdk2, циклин E, Cdk4, сурвивин, активируют супрессоры цитокиновых сигналов (SOCS3), модулируют системы TOR/S6K и JAK/STAT3 [3, 5, 10, 17, 23]. Воздействуя на автофагию [24], модулируя функции митохондрий [3, 17], ЛФ усиливает апоптоз злокачественных клеток.
Учитывая, что нарушение баланса в системе антиоксидантов, дефекты гликозилирования и сбой функции иммунной системы в значительной степени задействованы в патогенезе онкологических заболеваний, лактоферрин, обладающий иммуномодулирующими свойствами и кроссвидовой биосовместимостью при пероральном применении, является крайне перспективным средством профилактики и лечения рака. Продемонстрировано в серии экспериментов, что нативный КЛФ блокирует деление клеток карциномы [3, 10] при раке простаты [25], раке молочной железы [3, 5, 10, 23], эффективен при лейкемии [4, 5], раке желудка и кишечника [5, 26], меланоме [10], миелоидной лимфоме и раке легкого [5,10,19]. Пероральное применение ЛФ подавляет метастазирование на модели карциномы у мышей [26].Установлено, что эффект зависит от степени насыщения ЛФ железом: апо- форма отличается более высокой цитотоксичностью [5, 10]. При использовании фрагментов ЛФ выраженность противораковых свойств зависит от размера и формы ароматических боковых цепей [27]. особо важна неоднократно подтвержденная способность ЛФ различать здоровые и злокачественно трансформированные клетки: данный белок цитотоксичен по отношению к клеткам опухоли, но практически не оказывает влияния на немалигнизированные клетки микроокружения [3, 5, 10, 19, 23].
Применение ЛФ перед химиотерапией подавляет рост опухоли, а также усиливает эффект последующей химиотерапии даже в случае устойчивых к лечению форм [21]. Добавление 0,5% КЛФ в питьевую воду мышей на фоне применения циклофосфамида и метотрексата нормализует состояние мембран клеток и функции иммунной системы [5].
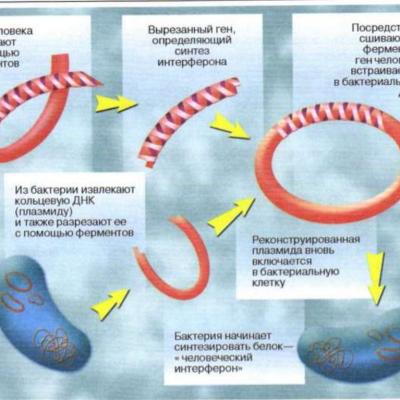
Немаловажна роль ЛФ в профилактике фиброзов на фоне лучевой терапии рака (радио-протекция). После добавления в рацион мышей 0,1% КЛФ в течение месяца, выживаемость после сублетального облучения возрастает в 1,5 раза, после ежедневного интраперитонеального введения 4 мг белка в течение того же срока выживаемость повышается практически вдвое [16]. С учетом биосовместимости лактоферрин является многообещающим носителем при генной терапии опухолей. Коньюгация ЛФ и лактоферрицина с 3-диаминомасляным полипропилен-имин-дендриплексом и ДнК, кодирующей фактор некроза опухоли, продемонстрировала усиление экспрессии и антипролиферативного эффекта в эксперименте, как на клеточных культурах, так и на мышах при внутривенном введении [28]. При этом снижалась неспецифическая экспрессия в клетках печени.
Проведен эксперимент по внедрению гена ЛФ в рекомбинантный аденовирус и введению мышам: продемонстрировано подавление роста и уменьшение размера опухоли на модели рака молочной железы [29].В экспериментах по коньюгации цитостатиков (доксорубицина) с ЛФ продемонстрирована цитотоксичность даже по отношению к резистентным к терапии клеткам опухоли [25]. Способность ЛФ проникать через гемато-энцефалический барьер использована при создании магнитных наночастиц для тераностики опухолей мозга [30].
Учитывая меньшую стабильность апоформы к разрушению в желудочно-кишечном тракте, осуществляется разработка новых лекарственных форм: альгинат-хитозан-кальций-фосфатных наночастиц, а также устойчивых к расщеплению крупных (более 200 кДа) олигомеров ЛФ [10].
Установлено, что эффективность апо-ЛФ повышается и при использовании положительно заряженных липосом, состоящих из фосфатидил-холина (ПК), диолеоилфосфатидилэтаноламина (До ФЭ), холестерина (хол) и стеариламина (Са) (соотношение 6: 1: 2: 1 м) в качестве системы-носителя [31].однако лактоферрин относится к числу немногих белков, разрушение которых не отменяет их регуляторные свойства [6]. Продукт пепсинового гидролиза ЛФ — лактоферрицин (ЛФЦ) состоит из 25 аминокислотных остатков (FK-CRRWQWRMKKLGAPSITCVRRAF) и обладает даже более выраженными цитотоксическими свойствами по отношению к раковым клеткам [17,19]. Продемонстрирована цитотоксическая активность ЛФЦ на клеточных и животных моделях при раке молочной железы, желудка, прямой кишки, лейкемии, меланоме, фибросаркоме [19, 32]. Лактоферрицин эффективен при лечении неходжкинской лимфомы у пациентов, резистентных к лечению моноклональными антителами к CD20, вызывает апоптоз по каспаза-независимому пути [32].Установлено, что катионные пептиды на основе ЛФЦ также обладают выраженной противораковой активностью: гексапептид RRWQWR способен различать раковые клетки и нормально функционирующие, присоединяться к трансформированным, лизировать их мембраны и запускать реакции апоптоза [19]. Проводятся исследования по усилению противоракового эффекта данного пептида при т-лейкемии и В-лимфоме, например, за счет добавления гептааргинина через глицин-глициновый линкер [18].
Малый размер катионных пептидов дает им явные преимущества: для инициации некролиза и апоптоза требуется значительно меньшее количество пептидов, чем крупных молекул ЛФ, обладающих единственным биоактивным участком в составе ЛФЦ. При сравнительном изучении мономерных, димерных, тетрамерных и циклических пептидов ЛФЦ, содержащих мотив RRWQWR, установлено, что цитолитическая активность против клеток рака молочной железы возрастает адекватно уровню полимеризации и имеет дозозависимый эффект [19]. Продемонстрировано, что при использовании малых доз пептидов развивается апоптоз, а при использовании высоких — некроз клеток опухоли [20]. Введение катионных пептидов ЛФЦ непосредственно в лимфому мышей вызывает ее полное рассасывание при инфильтрации опухоли цитотоксическими лимфоцитами. Пептид LTX-315 на основе оптимизированной структуры лактоферрицина отличается цитотоксичностью по отношению к клеткам меланомы, активирует лизис злокачественных клеток, воздействует на мембраны митохондрий, приводит к ультра-структурным изменениям и выбросу DAMP, способных активировать антиген-представляющие клетки [33], усиливает инфильтрацию опухоли лимфоцитами, повышает уровень ИЛ-1β и ИЛ-6, уничтожает опухоль на модели in vivo [34]. Эксперименты на модели лейкемии in vivo, in vitro также продемонстрировали эффективность пептидов [4].
Сведения о безопасности применения КЛФ подтверждены клиническими испытаниями, в том числе на детях [35]. однако публикации по применению КЛФ для терапии онкопатологии у людей крайне малочисленны и противоречивы.
При изучении эффективности рекомбинантного талактоферрина при мелкоклеточном раке легкого, не получено достоверных различий с плацебо [36], однако клинические испытания при данной патологии проводились при тяжелых стадиях — отсутствие эффективности может быть объяснено исчерпанием ресурсов организма на фоне крайне агрессивной разновидности рака. не исключено и влияние измененной гликозилированности рекомбинантного ЛФ на его эффективность. аналогичные исследования при немелкоклеточной форме оказались более многообещающими, но нуждаются в дополнительном подтверждении [37].
Описаны результаты клинических испытаний у больных с солидными опухолями: КЛФ назначали курсово (по 1,5-9 г) в течение 2 недель перорально, с перерывами 2 недели. Продемонстрировано, что препарат безопасен, наблюдалось статистически значимое увеличение циркулирующего IL-18 (показатель активности ЛФ). У 88% пациентов отмечено снижение скорости роста опухоли. Пациенты с немелкоклеточным раком легкого (NSCLC) выжили в течение как минимум одного года после начала монотерапии ЛФ [38].
При аденоматозных колоректальных полипах (предрак), ежедневный прием 1,5-3 г КЛФ в течение года приводит к полному рассасыванию полипов, не отмечено случаев перехода в колоректальный рак [39].
Курьезным, но перспективным при лечении онкопатологии у детей представляется клиническое испытание мороженого, содержащего ЛФ, для предотвращения диареи, развивающейся на фоне химиотерапии [40].
Заключение
ВОПРОСЫ ОНКОЛОГИИ. 2019, ТОМ 65, No 6