Авторы: Сиан Пан, Хуитинг Венг, Гухонг Ху, Шивен Ван, Тянь Чжао, Сюэпин Яо, Либин Ляо, Сяопэн Чжу, Яншань Гэ
Опубликовано в сети: 17 сентября 2021 г. https://doi.org/10.3892/ijo.2021.5265
Реферат
1. Введение
Лактоферрин (Lf) с молекулярной массой 77–80 кДа представляет собой железосвязывающий гликопротеин, выполняющий множество функций в организме; он участвует в апоптозе раковых клеток и может регулировать различные иммунные реакции ( 1 ). ЛФ был впервые обнаружен в 1939 году и представляет собой «красный белок», содержащийся в молоке; его можно отделить и очистить от грудного и коровьего молока. Выделенная структура белка Lf аналогична структуре трансферрина сыворотки, с гомологией последовательности 60%, и он обратимо связывается с ионами железа (Fe 3+ ) ( 2 ). Таким образом, ЛФ классифицируется как член семейства трансферринов вместе с трансферрином сыворотки, меланотрансферрином и овотрансферрином ( 3) .). Этот многофункциональный белок присутствует в выделениях слизистых оболочек, включая слезы, слюну, выделения из влагалища, сперму, выделения из носа, выделения из бронхов, желчь, желудочно-кишечные выделения, мочу, коровье и грудное молоко (4 ) . ЛФ также присутствует на поверхности слизистой оболочки и гранулах лейкоцитов. Грудное молоко и коровье молоко являются наиболее богатыми источниками ЛФ ( 5 ). Lf очень похож между разными видами. Фактически, гомология между ЛФ человека и крупного рогатого скота составляет 77% ( 6 ).
ЛФ способствует усвоению железа организмом; он регулирует рост клеток, удаляет вредные свободные радикалы и подавляет образование токсичных соединений. В регуляции иммунных реакций ЛФ проявляет антибактериальную, противовирусную, антиоксидантную, противораковую и противовоспалительную активность ( 5 ). Соответственно, ЛФ добавляют в ряд коммерческих продуктов, включая детские смеси, кисломолочные продукты, косметику, лечебные напитки, зубную пасту и другие продукты, используемые в повседневной жизни (7 ) .
В клетках стромы эндометрия человека ( 8 ) и эмбриональных клетках почек человека ЛФ может усиливать синтез ДНК в нормальных клетках дозозависимым образом ( 9 ). Кроме того, другая форма Lf, ∆Lf, может экспрессироваться в клетках железистого эпителия, таких как клетки простаты и слюнных желез. ∆Lf представляет собой белковый подтип Lf, в котором отсутствует лидерная последовательность и первые 25 остатков исходного белка ( 10 ). Укороченная белковая мРНК обнаруживается во всех нормальных тканях, но не в некоторых клеточных линиях, полученных из опухоли. Несколько исследований показали, что участок хромосомы, кодирующий Lf, удаляется в различных опухолях, что является спонтанным процессом, который может происходить при раке ( 11) .). ∆Lf играет роль фактора транскрипции в клетках, участвует в регуляции экспрессии специфических генов и играет роль в развитии рака ( 12 ). Ряд исследований in vivo показал потенциальный противоопухолевый эффект ЛФ, предполагая, что пероральное введение бычьего ЛФ (бЛФ) может снижать химически индуцированный канцерогенез у грызунов, наряду с выраженной цитотоксической и антиметастатической активностью в отношении многочисленных линий раковых клеток ( 13 , 14 ). Противоопухолевый эффект ЛФ действует через ряд различных механизмов, включая индукцию апоптоза в опухолевых тканях ( 7 ).
Благодаря сверхэкспрессии ряда рецепторов клеточной поверхности, ЛФ обладает положительным нацеливающим эффектом; поэтому он считается идеальным наноносителем для некоторых гидрофобных терапевтических агентов. Кроме того, поскольку ЛФ может преодолевать гематоэнцефалический барьер (ГЭБ), он оказался хорошим кандидатом для производства наноносителей для специфической доставки лекарств от опухолей головного мозга. Таким образом, Lf представляется многообещающей молекулой с множеством применений в области лечения рака и наномедицины. ЛФ имеет многочисленные преимущества с точки зрения его способности активно участвовать в производстве наноносителей. Кроме того, это один из немногих белков, которые в физиологических условиях имеют суммарный положительный заряд [изоэлектрическая точка (pI) 8,0–8,5]. Благодаря высокому значению pI, Lf положительно заряжен в широком диапазоне значений pH (15 ), достаточно стабилен в желудочно-кишечном тракте и обладает рядом кишечных рецепторов, которые облегчают пероральное всасывание и биодоступность наноносителей на основе ЛФ в кровотоке.
2. ЛФ оказывает как иммуностимулирующее, так и иммуномодулирующее действие.
ЛФ является естественным иммуномодулятором, который играет роль во врожденной и приобретенной иммунной системах, которые регулируют образование антител, созревание Т- и В-клеток и увеличивают процент естественных клеток-киллеров в популяции лимфоцитов (16 ) . Способность ЛФ регулировать активность иммунного ответа может быть связана с его способностью связывать эндотоксины [липополисахариды (ЛПС)] ( 17 , 18 ). В предыдущем исследовании было обнаружено, что ЛФ облегчает клеточное воспаление, вызванное ЛПС, путем ослабления ядерных путей протеинкиназы, активируемой митогеном, фактора-κB, смягчения окислительного стресса и поддержания целостности клеточного барьера. Такой вывод означает, что ЛФ играет важную роль в иммунной регуляции ( 19). Когда грамотрицательные бактерии пытаются внедриться в человека-хозяина, они вступают в контакт с различными белками врожденной иммунной системы. Часть наружной мембраны бактерий содержит ЛПС. Когда этот «связанный с патогеном молекулярный паттерн» распознается Toll-подобным рецептором 4, он запускает ряд иммунных ответов в различных лейкоцитах и тромбоцитах ( 20 , 21) .). Комбинация ЛФ и эндотоксинов, выделяемых бактериями, может снизить степень стимуляции иммунной системы. Этот процесс может предотвратить перевозбуждение, которое иногда возникает при таких заболеваниях, как сепсис. Пептид hLf1-11, полученный из лактоферрина человека (hLf), может ингибировать миелопероксидазу, которая является основным защитным ферментом хозяина, обнаруженным в различных лейкоцитах, что может дополнительно снижать врожденный иммунный ответ (22 ) . Кроме того, было показано, что hLf стимулирует созревание дендритных клеток и рекрутирует различные лейкоциты ( 23 ). Следовательно, ЛФ играет активирующую роль во врожденных и адаптивных иммунных реакциях.
Лактоферрин является аллостерическим усилителем протеолитической активности катепсина G, тем самым влияя на функцию адаптивных иммунных клеток ( 24 ). ЛФ имеет положительный заряд, который позволяет ему связываться с отрицательно заряженными поверхностными молекулами различных клеток иммунной системы, и считается, что это соединение запускает сигнальные пути, которые приводят к клеточным реакциям, таким как активация, дифференцировка и пролиферация. ЛФ может транспортироваться в ядро, чтобы связываться с ДНК и активировать различные сигнальные пути ( 25) .). Лактоферрин может связываться с ДНК и благодаря своей положительно заряженной N-концевой области, которая остается связанной с вытесненной ДНК во внеклеточных ловушках нейтрофилов, все еще может способствовать уничтожению бактерий в этом процессе. Поскольку гранулы также секретируют различные протеолитические ферменты, Lf или другие полипептиды также могут локально высвобождаться из интактного Lf ( 26 ).
Наряду с индукцией системного иммунитета, Lf способствует кожному иммунитету и подавляет аллергические реакции ( 27 ). Иммунная система активируется против кожных аллергенов, что приводит к дозозависимому ингибированию миграции клеток Лангерганса и накоплению дендритных клеток в лимфатических узлах. Воздействие цитокинов, провоспалительных цитокинов, TNF-α, IL-6 и IL-1β на лейкоцитарный Lf может регулироваться в сторону увеличения или уменьшения. Производство этих факторов зависит от типа сигнала, распознаваемого иммунной системой. На клеточном уровне ЛФ может увеличивать количество CD4 + и CD8 + клеток в естественных киллерах (NK) и Т-клетках ( 28) .), способствуют набору лейкоцитов в кровь, вызывают фагоцитоз и регулируют процесс образования костного мозга ( 29 ). ЛФ также увеличивает экспрессию гиалуроновой кислоты, которая необходима для образования грануляционной ткани, активирует тромбоцитарные факторы роста и способствует пролиферации и миграции кератиноцитов; это необходимое условие реэпителизации ран. ЛФ также защищает клетки от апоптоза ( 30 ).
3. ЛФ – естественный иммуномодулятор, участвующий в противоопухолевом ответе.
ЛФ считается ключевым компонентом первой линии защиты человеческого организма ( 15 ) и обладает разнообразными биологическими эффектами, включая регуляцию иммунного ответа, всасывание железа, а также противовоспалительную и антиоксидантную активность. ЛФ оказывает противоопухолевое действие посредством различных механизмов. Пероральный прием bLf может снижать химически индуцированный канцерогенез у грызунов и обладает значительной цитотоксичностью и антиметастатической активностью в отношении многочисленных линий раковых клеток, таких как линии клеток рака молочной железы и рака желудка ( 31 , 32 ). В таблице I приведены некоторые антиканцерогенные механизмы Lf.
ЛФ является фактором выживания ревматоидных синовиальных нейтрофилов, железосвязывающим белком, который высвобождается из активированных нейтрофилов в очагах воспаления и обладает противовоспалительными и антибактериальными свойствами (33 ) . Хотя выделение железа с помощью Lf и прямое воздействие на активные промежуточные соединения кислорода являются основными факторами снижения чрезмерного повреждения воспалительной реакции за счет непосредственного контроля развития иммунных функций более высокого порядка, Lf может регулировать повреждение и патологию, вызванную повреждением. В конечном итоге это приводит к уменьшению патологического повреждения при воспалении ( 34 ). Механизм действия ЛФ включает компонент, который по-разному регулирует клеточный иммунный ответ в моделях сепсиса in vivo.. Апоптотические клетки могут высвобождать Lf и объединяться с нейтрофилами, чтобы ингибировать хемотаксис нейтрофилов, позволяя макрофагам поглощать апоптотические клетки, тем самым оказывая противовоспалительное действие
Bezault и коллеги ( 36 ) впервые подтвердили противоопухолевую активность ЛФ на моделях фибросаркомы и меланомы у мышей. Кроме того, внутрибрюшинная инъекция hLh может ингибировать рост солидных опухолей и метастазирование в легкие, независимо от насыщения белка железом. Примечательно, что противораковая способность ЛФ связана с наличием NK-клеток. Чтобы дополнительно доказать значимость ЛФ в противоопухолевой активности, Damiens et al ( 37 ) изучили роль ЛФ в прогрессировании рака при воспалительных состояниях. Экспериментальные результаты показали, что ЛФ регулирует цитотоксичность NK-клеток и чувствительность клеток-мишеней к лизису. Аналогичные результаты были получены и в опытах Ши и Ли ( 38). Однако Iyer et al ( 39 ) указали, что противоопухолевые свойства Lf могут быть частично обусловлены его свойствами связывания железа. Свободное железо может действовать как мутагенный стимулятор, индуцируя окислительное повреждение структуры нуклеиновой кислоты ( 40 ), тем самым снижая риск возникновения опухолей, вызванных окислением ( рис. 2 ) ( 41 , 42 ).
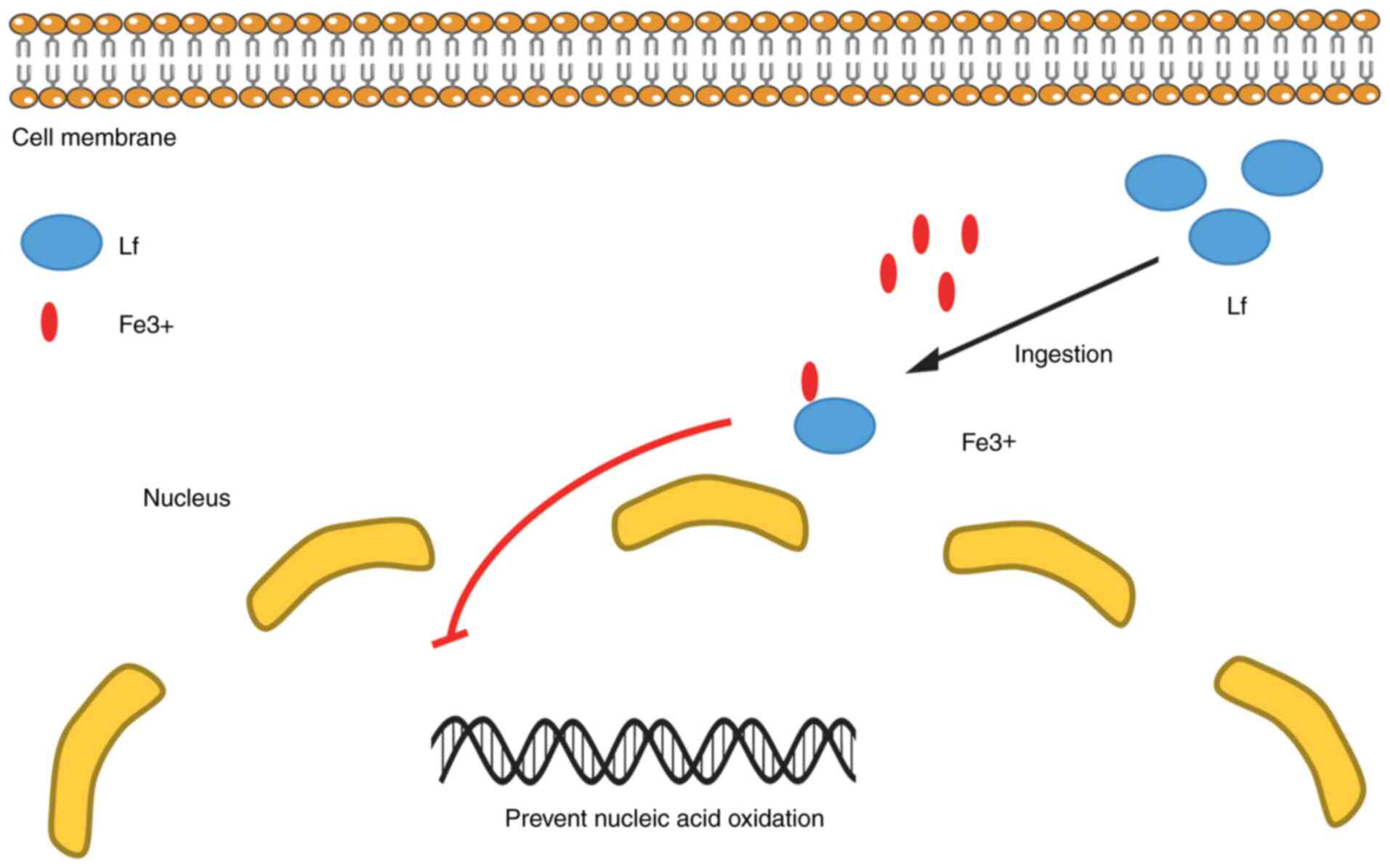 |
Рисунок 2Лактоферрин классифицируется как белок, связывающий железо. Железо образуется из ионов металлов, оказывающих каталитическое действие на образование гидроксильных радикалов, подавляющих активность защитных клеток хозяина. Было высказано предположение, что благодаря своим железосвязывающим свойствам ЛФ играет роль в поглощении железа слизистой оболочкой кишечника и действует как бактериостатический агент, удерживая железо от железо-требующих бактерий. Железосвязывающие свойства ЛФ могут способствовать его противоопухолевым свойствам. Лф, лактоферрин. |

-
Перспективы применения лактоферрина и его производных в лечении онкологических заболеваний
Федеральное государственное унитарное предприятие «государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства
Ежегодно регистрируется более 250 тысяч смертей от злокачественных новообразований в России и 8 миллионов в мире. Эффективность традиционных методов лечения, а также моноклональных антител и генной терапии лимитирована в случае резистентных форм и труднодоступной локализации опухоли.
-
Функции лактоферрина женского молока
1. Функции лактоферрина женского молока
Лактоферрин – представитель семейства трансферринов, который синтезируется эпителиальными клетками внутренних желез млекопитающих и широко представлен в различных секреторных жидкостях, таких как молоко, слюна, слёзы, секреты носовых желез.
Лактоферрин является одним из компонентов иммунной системы организма, принимает участие в системе врожденного гуморального иммунитета, регулирует функции иммунокомпетентных клеток и является белком острой фазы воспаления /1/.
Лактоферрин относится к полифункциональным белкам грудного молока, защитные свойства которого уникальны.
Первоначально лактоферрин рассматривался только как железосвязывающий белок молока с бактериостатическими свойствами, но к настоящему времени получено много экспериментальных данных и доказательств, указывающих на то, что этот белок обладает множественными физиологическими свойствами.
Ниже перечислены только некоторые из свойств лактоферрина. А о скольких еще мы не знаем!
1. Наиболее изученная функция - регулирование содержания железа в организме.
Корректная регуляция концентрации ионов железа в организме жизненно важна, поскольку железо участвует во многих метаболических процессах. Однако, избыток железа не менее вреден, чем его недостаток и приводит к активации микробного роста, разрушению клеток под действием свободных радикалов.
Предполагается, что роль лактоферрина при вскармливании заключается в маскировании железа в молоке. Лактоферрин выступает как фактор, лимитирующий содержание железа, доступного для микроорганизмов. Связывая ионы «лишнего» железа и других металлов, лактоферрин лишает патогенную флору жизненно важных микроэлементов /2/.
2. Преимущественная локализация лактоферрина в секреторных жидкостях косвенно указывала на то, что основная функция этого белка в защите слизистых от патогенов.
В дальнейшем было установлено, что лактоферрин эффективно используется в защите организма от энтеральных инфекций и обладает способностью подавлять широкий диапазон микробных агентов, независимо от своей способности связывать железо. Наиболее изученным механизмом антибактериального действия белка является специфическое взаимодействие лактоферрина с наружной бактериальной мембраной, которое приводит к гибели клеток бактерий /3/.
3. Доказано, что лактоферрин обладает антивирусной активностью против широкого спектра вирусов человека и животных с ДНК и РНК геномами.
Лактоферрин связывает различные антигены вирусной природы преимущественно в условиях in vitro /4/.
На данный момент показано действие белка против вирусов простого герпеса 1 и 2, цитомегаловируса, ВИЧ, вируса гепатита С, хантавирусов, ротавирусов, полиовирусов первого типа, аденовирусов, респираторного синцитиального вируса, мышиного вируса лейкоза Френда /1/.
Именно поэтому так часто практикуемое в отечественных больницах прекращение грудного вскармливания при ротавирусных инфекциях является очень грубой ошибкой терапии.
4. Помимо прямого антимикробного действия, лактоферрин может влиять на воспалительный процесс, вызываемый микробной инфекцией.
Это подтверждается экспериментами, в которых присутствие лактоферрина защищает от гастритов, индуцируемых Helicobacter pylori, поддерживает целостность слизистой кишечника от воздействия бактериального липополисахарида, снижает токсичность и даже смертность при высоком инфицировании энтеротоксичным штаммом E. сoli /3/.
5. Лактоферрин обладает также и противогрибковой активностью. Например, против Candida albicans - симбионтов, образующих колонии в слизистой оболочке ротовой полости здоровых людей.
Исследования, проводимые на мышах с ослабленным иммунитетом и симптомами стоматита, приводили к значительному уменьшению числа Candida albicans в ротовой полости и размеров поражения языка. Показано, что оральное введение лактоферрина уменьшает количество патогенных организмов в тканях, близких к желудочно-кишечному тракту у нескольких моделей инфицированных животных /11/.
Более того, ВИЧ-инфицированные больные с Candida albicans, устойчивых к антигрибковым препаратам, полностью избавлялись от грибковой инфекции после введения смеси, содержащей лактоферрин /13/.
6. Лечение с помощью лактоферрина онкобольных, посредством введения его внутривенно, показывает очень хорошие и обнадеживающие результаты /5/.
7. Известно, что рост и развитие желудочно-кишечного тракта новорожденных животных, вскармливаемых материнским молоком, интенсивнее, чем у вскармливаемых молочными смесями.
Исследования показали, что лактоферрин человека является фактором, стимулирующим этот рост, и эта способность тоже не зависит от наличия связанного железа. Это открытие увеличивает значимость лактоферрина в желудочно-кишечном тракте ребенка: лактоферрин не только является источником железа и аминокислот, но и способствует клеточному росту /6/.
8. Современные исследования новозеландских ученых позволили открыть новую активность лактоферрина, которая позволяет рассматривать лактоферрин как регулятор роста костной ткани.
Было установлено, что лактоферрин защищает кость от истончения (остеопороза).
Результаты исследований показывают, что лактоферрин является наиболее сильным активатором роста кости в сравнении с уже известными факторами, включая эпидермальный фактор роста. Опыты на мышах привели к 4-х кратному увеличению костной массы животного по сравнению с контролем /14/.
Таким образом, физиологические свойства лактоферрина поразительно разнообразны. К ним относятся:
- защита организма от бактериальных, вирусных и грибковых инфекций;
- контроль концентрации ионов железа в биологических жидкостях;
- противовоспалительная и иммуномодулирующая активность;
- регуляция клеточного роста и дифференцировки (для костной ткани и кишечника);
- замедление роста раковых опухолей и метастазирования /7/.
Ряд интереснейших свойств лактоферрина удобнее рассматривать, пользуясь схемой /8/.
![laktoferrin]()
- Зеленым цветом отмечены глобальные активности лактоферрина - защита от бактерий, вирусов, грибков и паразитов, уничтожение раковых клеток по механизму апоптоза, регуляция функций иммунной системы и воспалительного процесса.
- Синим цветом отмечены ферментативные активности, отвечающие за расщепление бактериальных и вирусных инфекционных факторов.
- Желтым цветом обозначены молекулярные механизмы действия лактоферрина, перекликающиеся с реализацией глобальных активностей.
2. Лактоферрин и анемия
Из всех анемий самой распространенной является железодефицитная (ЖДА), которая составляет примерно 80% от всех анемий.
ЖДА — это клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка.
Особенно активно всасывание железа происходит из грудного молока, хотя его содержание в нем невелико — всего 1,5 мг в литре; биодоступность железа грудного молока составляет до 60%.
Этому способствует особая форма, в которой оно представлено, — в виде железосодержащего белка лактоферрина.
Лактоферрин в грудном молоке содержится в виде насыщенной (связанной с железом) и ненасыщенной форм. Соотношение форм лактоферрина меняется в зависимости от периода лактации. В течение первых 1–3 месяцев жизни превалирует насыщенная железотранспортная форма лактоферрина. Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистой оболочки кишечника способствует адгезии с ними лактоферрина и более полной его утилизации.
Важнейшим фактором коррекции железодефицита является сбалансированное питание, и в первую очередь грудное вскармливание.
Грудное молоко не только содержит железо в высокобиодоступной форме, но и повышает абсорбцию железа из других продуктов, употребляемых одновременно с ним /9/.
3. Применение лактоферрина в фармакологии и детском питании
- В Японии после активных многолетних исследований создали лекарственный препарат на основе лактоферрина коровьего молока, который используют для лечения диареи, вызванной ротавирусной инфекцией у детей. Также этот препарат предотвращал развитие рака печени у больных с гепатитом С /15/.
- В Италии проведены успешные исследования по применению лактоферрина коровы для лечения анемии беременных /16/.
- В Московском НИИ онкологии им. П.А.Герцена наладили выделение лактоферрина из грудного молока для лечения онкологических больных в послеоперационном периоде и получают хорошие результаты такой терапии /7/.
- На данном этапе развития промышленности добавление лактоферрина в искусственные смеси для вскармливания детей крайне затруднено и дорогостояще, поэтому в массовых объемах не осуществляется /5/.
Производство 1 грамма лактоферрина стоит более 3000 долларов /10/!
4. Результаты исследования женского молока на содержание лактоферрина.
В Отделе молекулярной генетики Научно-исследовательского института экспериментальной медицины СЗО РАМН в Санкт-Петербурге уже много лет изучают свойства многофункционального белка грудного молока – лактоферрина. Далее - краткий обзор первых результатов /2/.
Вопрос о целесообразности грудного вскармливания после одного года широко обсуждается на конференциях консультантов по грудному вскармливанию и педиатров. Целью данного исследования было определение содержания лактоферрина и его насыщенности железом и медью в образцах молока женщин. На добровольной основе 15 женщин на протяжении 2 лет лактации собрали образцы грудного молока (более 7000 образцов), в которых проанализировано содержание лактоферрина.
В течение первой недели лактации концентрация лактоферрина в молозиве составляла 2–8 мг/мл, далее концентрация лактоферрина постепенно понижалась и к концу первого года лактации составляла от 0,5 до 2 мг/мл.
На протяжении второго года лактации концентрация лактоферрина составляла 0,5–1 мг/мл.
На сроках лактации свыше двух лет мы получили всего 24 образца с рекордными сроками до пяти лет лактации. В них содержание лактоферрина составляло от 2 до 5 мг/мл, т. е. по содержанию лактоферрина такое молоко было близко к молозиву.
Оценка объема позднего молока позволяет предположить, что ежедневно ребенок получает с ним более 50 мг лактоферрина, что близко к терапевтической дозе лактоферрина для больных онкологическими заболеваниями.
Таблица 1.
![laktoferrin1]()
Таблица 2.
![laktoferrin3]()
Результаты данного исследования ставят под сомнение распространенную среди педиатров точку зрения, что в грудном молоке после первого года лактации не содержится полезных для ребенка веществ.
Мельникова Рада,
консультант по грудному вскармливанию
-
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ РЕКОМБИНАНТНОГО ЛАКТОФЕРРИНА ЧЕЛОВЕКА И ЕГО ПРОИЗВОДНЫХ
Трубицина Т.П., Колоскова Е.М., Езерский В.А., Максименко С.В.,
Белова Н.В., Кутьин И.В., Рябых В.П.
ВНИИ физиологии, биохимии и питания животных - филиал ФНЦ
животноводства ВИЖ им. Л.К. Эрнста,
Боровск Калужской обл., Российская Федерация
В связи с появлением на мировом рынке трансгенных сельскохозяйственных животных (коз, коров), продуцирующих с молоком биологически активные белки человека, в том числе лактоферрин человека, активно обсуждаются вопросы по возможным направлениям развития этой области исследований и обеспечению безопасности применения получаемых продуктов. Как показывают многочисленные исследования, лактоферрин (человека и крупного рогатого скота, рекомбинантный и нативный), обладает большим терапевтическим потенциалом, который до настоящего времени практически не используется из-за дефицитности традиционного источника его получения (женское молоко в ранние сроки лактации) и низкого содержания в коровьем молоке. -
Таблица I – Антиканцерогенная активность Lf в отношении различных типов опухолей.
Таблица I
Антиканцерогенная активность Лф в отношении различных типов опухолей.
Рак, связанный с Lf Белок Исход (Ссылки) Рак молочной железы hLf Задержание раковых клеток в фазе G0 / G1 , индукция апоптоза и модуляция экспрессии Bcl-2 и Bax. (100) бЛф Подавление VH + АТФазы и снижение кислотности микроокружения опухоли (101) Колоректальный рак чЛф, бЛф Увеличение экспрессии TGF-β1, стимуляция секреции IL-18 в клетках Caco-2. (102) бЛф Усиленная инфильтрация клеток CD4 + и CD8 + , увеличение продукции IL-18. (103) ГБМ hLf Подавление пролиферации первичных клеток NMD и FN за счет снижения экспрессии циклина D1 и D4. (104) Рак легких hLf Антипролиферативные эффекты объясняются повышенным уровнем гипофосфорилированного Rb в клетках H1299. (105) бЛф Снижение уровней цитокинов TNF-α, IL-4, IL-6 и IL-10, ограничивающих воспаление и ограничивающих пролиферацию опухоли. (106) НПС hLf Снижение уровня регуляции PDPK1 через путь MAPK/c-Jun и подавление стимуляции AKT, облегчаемой K18. (107) ОССС бЛф Избирательное подавление роста через сигнальные пути mTOR/S6K и JAK/STAT3 и запуск апоптоза при OSCC (108) Рак простаты бЛф Ингибирование V-АТФазы плазматической мембраны, подавляющее прогрессирование опухоли и метастазирование в клетках PC-3. (14) -
ИССЛЕДОВАНИЕ ЭффЕКТОВ РЕКОМБИНАНТНОГО ЛАКТОфЕРРИНА ЧЕЛОВЕКА НА ПРОЛИфЕРАЦИЮ И АПОПТОЗ РАКОВЫХ И ИММОРТАЛИЗИРОВАННЫХ КЛЕТОК
1ГНУ «Институт генетики и цитологии НАН Беларуси»
Республика Беларусь, 220072, г. Минск, ул. Академическая, 27
2РУП «НПЦ НАН Беларуси по животноводству»
Республика Беларусь, 222160, г. Жодино, ул. Фрунзе, 11Введение
Впервые лактоферрин (ЛФ) был обнаружен в молоке коров. Позже ЛФ был найден в клетках матки, в миелоидных клетках (особенно в гранулоцитах) и клетках мозга [1]. Первоначально ЛФ рассматривался как железосвязывающий белок молока с бактериостатическими свойствами. железо участвует в различных метаболических процессах, и регуляция его концентрации чрезвычайно важна. В частности, аномально высокое содержание железа приводит к повышенной продукции свобод ных радикалов, повреждающих белки и ДНК [2]. Кроме того, избыток железа приводит к активации микробного роста [3].
Многочисленные исследования ( 43-45 ) показали, что экзогенное лечение ЛФ и его производными может эффективно ингибировать рост опухоли и снижать ее восприимчивость . В частности, подавление или молчание Lf и его производных может привести к увеличению вероятности развития опухоли ( 46 ). И наоборот, пролиферация раковых клеток предотвращается после восстановления гена Lf ( 47). Однако эти исследования не позволили окончательно установить механизм, лежащий в основе противоракового действия ЛФ. В этом обзоре обсуждаются потенциальные применения экспрессии гена Lf в лечении рака и связь между Lf и раком. На сегодняшний день установлено, что цитотоксичность ЛФ в отношении некоторых видов рака проявляется тремя способами при различных условиях: i) разрушение клеточных мембран; ii) индукция клеточного апоптоза; и iii) остановка клеточного цикла и клеточный иммунный ответ.
Разрушение клеточных мембран
Lf и производные от него пептиды легко эндоцитируются клетками Jurkat. Cutone et al ( 48 ) обнаружили, что в Т-лимфоцитах ЛФ проникает в клетки посредством рецептор-опосредованного эндоцитоза и почти полностью разрушается в лизосомах. Lf-активный пептид, Lf-B, также проявляет конформационно-зависимую эффективность поглощения ( 49 ). Увеличение проницаемости мембраны может изменить барьерную функцию мембраны и способствовать гибели клеток. В низких концентрациях Lf и его производные пептиды могут усиливать лизис клеток, а в высоких концентрациях Lf может регулировать лизис клеток в зависимости от фенотипа клеток-мишеней ( 50 ). Большинство раковых клеток содержат большое количество протеогликанов, аминогликанов и сиаловой кислоты, которые взаимодействуют с ЛФ ( 51) ., 52 ). Это распознавание может лежать в основе специфичности и селективности противоопухолевых препаратов ЛФ. Например, Riedl et al ( 50 ) обнаружили, что фосфатидилсерин, компонент цитоплазматической мембраны, в основном обнаруживаемый в опухолевых клетках, является ключевой мишенью для специфической противораковой активности производных hLf. Это избирательное взаимодействие через рецепторы клеточной поверхности на самом деле является цитотоксической реакцией. В частности, в высоких концентрациях hLf и bLf и полученные из них пептиды, как было показано, способствуют цитотоксичности и гибели клеток у прокариотических и эукариотических патогенов и раковых клеток ( 53 , 54) .). В основном это связано с катионным зарядом Lf. ЛФ может способствовать электростатическим взаимодействиям с отрицательно заряженными рецепторами клеточной поверхности. Катионные пептиды, полученные из LF, имеют низкое массовое отношение и могут проникать в клеточную мембрану и нарушать ее стабильность, тем самым легко вызывая растворение клеточной мембраны ( 55 ).
Индукция апоптоза
Апоптоз клеток, индуцированный Lf, был описан как ключевой путь, посредством которого пептиды проявляют свои цитотоксические эффекты против различных раковых клеток. Однако путь апоптоза, который они запускают, зависит от типа клеток ( 56 , 57 ).
В предыдущем исследовании клетки рака желудка SGC-7901 обрабатывали ЛФ, и в результате фосфорилированный Akt и многочисленные ключевые белки, участвующие в сигнальном пути Akt, были снижены. Однако уровни экспрессии фосфорилированной каспазы-9 и фосфорилированной киназы-3β гликогенсинтазы были повышены, что указывает на то, что в клетках рака желудка SGC-7901 индуцированный Lf апоптоз может регулироваться посредством Akt-пути (32 ) . Также было обнаружено, что Lf индуцирует связанный со стрессом митоген-активируемый путь протеинкиназы в Т-клетках Jurkat, где предполагается, что N-концевая киназа c-Jun (JNK), связанная с Bcl-2, является путем, ответственным за апоптоз, индуцированный Lf. ( 58). Обработка ЛФ индуцировала активацию каспаз-9 и -3 и повышала уровень фосфорилирования Bcl-2. После отмены активации JNK в клетках Jurkat, обработанных Lf, не происходило гибели клеток. Кроме того, было показано, что BLf индуцирует внешний путь апоптоза путем усиления передачи сигналов Fas в слизистой оболочке толстой кишки крыс, получавших азоксиметан ( 59 ).
Остановка клеточного цикла и клеточный иммунный ответ
Клеточные циклы млекопитающих обычно строго контролируются гормонами и факторами роста, и нарушение регуляции может привести к опухолям. Циклины, циклинзависимые киназы (CdK) и их антагонисты, ингибиторы CdK, являются ключевыми факторами, регулирующими ход клеточного цикла. Было обнаружено, что в клетках рака молочной железы MDA-MB-231 hLF ингибирует рост клеток во время фазы перехода от G 1 к S клеточного цикла. На молекулярном уровне hLF индуцирует значительное снижение уровня белка и активности Cdk2 и Cdk4, активирует циклины D и E и играет ключевую роль в переходе от G1 к S-фазе ( 60 ) . Подобные эффекты hLf также были зарегистрированы в четырех моделях раковых клеток головы и шеи с блокировкой G1 .к S-фазе после лечения hLf ( 61 ). Сообщалось, что Lf индуцирует остановку роста клеток за счет снижения фосфо-Akt, что приводит к увеличению экспрессии и активности p21Cip1 и p27Kip1 ( 62 ).
Было подтверждено, что ЛФ усиливает адаптивный иммунный ответ и является эффективным противовоспалительным средством ( 63 ). Хотя его молекулярный механизм еще предстоит раскрыть, исследователи обнаружили, что как hLf, так и bLf могут проникать в ядро клетки-хозяина и связываться с ДНК, чтобы регулировать экспрессию генов, тем самым проявляя свою противовоспалительную активность (64 ) . hLf значительно увеличивает опосредованную NK-клетками цитотоксичность в клеточных линиях рака молочной железы и рака толстой кишки ( 65 ).
4. ЛФ оказывает противораковое действие на опухоли центральной нервной системы.
Tammam et al ( 66 ) выявили, что цитотоксичность ЛФ по отношению к глиомам может быть связана с его цитоплазматическим распределением. Ядерная передача Lf индуцирует клеточную пролиферацию, а не цитотоксичность, что свидетельствует о том, что механизм действия Lf при глиоме связан с расположением клеток.
Хорошо известно, что опухолевые клетки сверхэкспрессируют рецепторы Lf, чтобы удовлетворить повышенные пищевые потребности этих высокопролиферативных клеток ( 67 ). ЛФ является идеальным наноносителем для некоторых гидрофобных терапевтических средств благодаря его активному потенциалу нацеливания в результате сверхэкспрессии его рецептора на поверхности ряда клеток. Кроме того, ЛФ является хорошим потенциальным кандидатом для изготовления наноносителей, которые специфически доставляют лекарства к опухолям головного мозга, поскольку ЛФ может проникать через ГЭБ. Следовательно, Lf представляется многообещающей молекулой с множеством применений в области терапии рака и наномедицины ( 68 ). Сонг и др. ( 69) продемонстрировали потенциальную полезность конъюгированных с Lf нанокомпозитов GO@Fe3O4 для терапевтического применения при лечении глиом ( 69 ). Наночастицы оксида железа, конъюгированные с Lf, можно использовать в качестве индикаторов для целенаправленной визуализации глиомы головного мозга с использованием визуализации магнитных частиц ( 70 ). Наногель гиалуроновой кислоты (ГК), функционализированный ЛФ/фенилбороновой кислотой, сшитый сшивающим агентом с дисульфидной связью, был создан в качестве чувствительной к уменьшению терапевтической платформы глиомы с двойным нацеливанием для доставки доксорубицина гидрохлорида (ДОКС) (71 ) . Lf-HA-DOX значительно увеличивал доставку лекарств к глиоме и, таким образом, может служить многообещающей терапией против глиомы ( 72 ).
5. ЛФ влияет на прогрессирование опухоли, оказывая антибактериальное и противовирусное действие.
ЛФ оказывает широкий ингибирующий эффект на антибактериальные инфекции.
Воспалительное заболевание кишечника — это хроническое воспалительное и рецидивирующее заболевание желудочно-кишечного тракта ( 73 ). В норме микробиота кишечника на 90 % состоит из Bacteroidetes и Firmicutes, а остальные 10 % составляют редкие типы, такие как Proteobacteria и Actinobacteria, а также грибы, вирусы и протисты. Антимикробная активность была описана как первая функция ЛФ, связанная с механизмами защиты предков-хозяев, нацеленными на патогенные инфекции. Эта активность оценивалась в нескольких исследованиях in vitro ( 74 , 75 ) и in vivo ( 76) .) модели, могут быть как независимыми, так и зависимыми от железосвязывающей способности Lf. Широко сообщалось о противораковой активности Lf посредством иммуномодуляции хозяина, особенно при колоректальном раке ( 43 ).
Lf является многофункциональным природным защитным белком со значительной антибактериальной активностью ( 77 ); его функция в основном выражается в поглощении Fe 3+ , что ограничивает использование Fe 3+ бактериями в инфицированном очаге, подавляет рост и размножение этих микроорганизмов и экспрессию их факторов вирулентности. Бактерицидный эффект ЛФ в основном опосредован его взаимодействием с бактериальной поверхностью. Исследования in vivo ( 78 ) и in vitro ( 79 ) показали, что Lf препятствует прикреплению некоторых бактерий к клеткам-хозяевам ( 15 ) ( рис. 3 ).
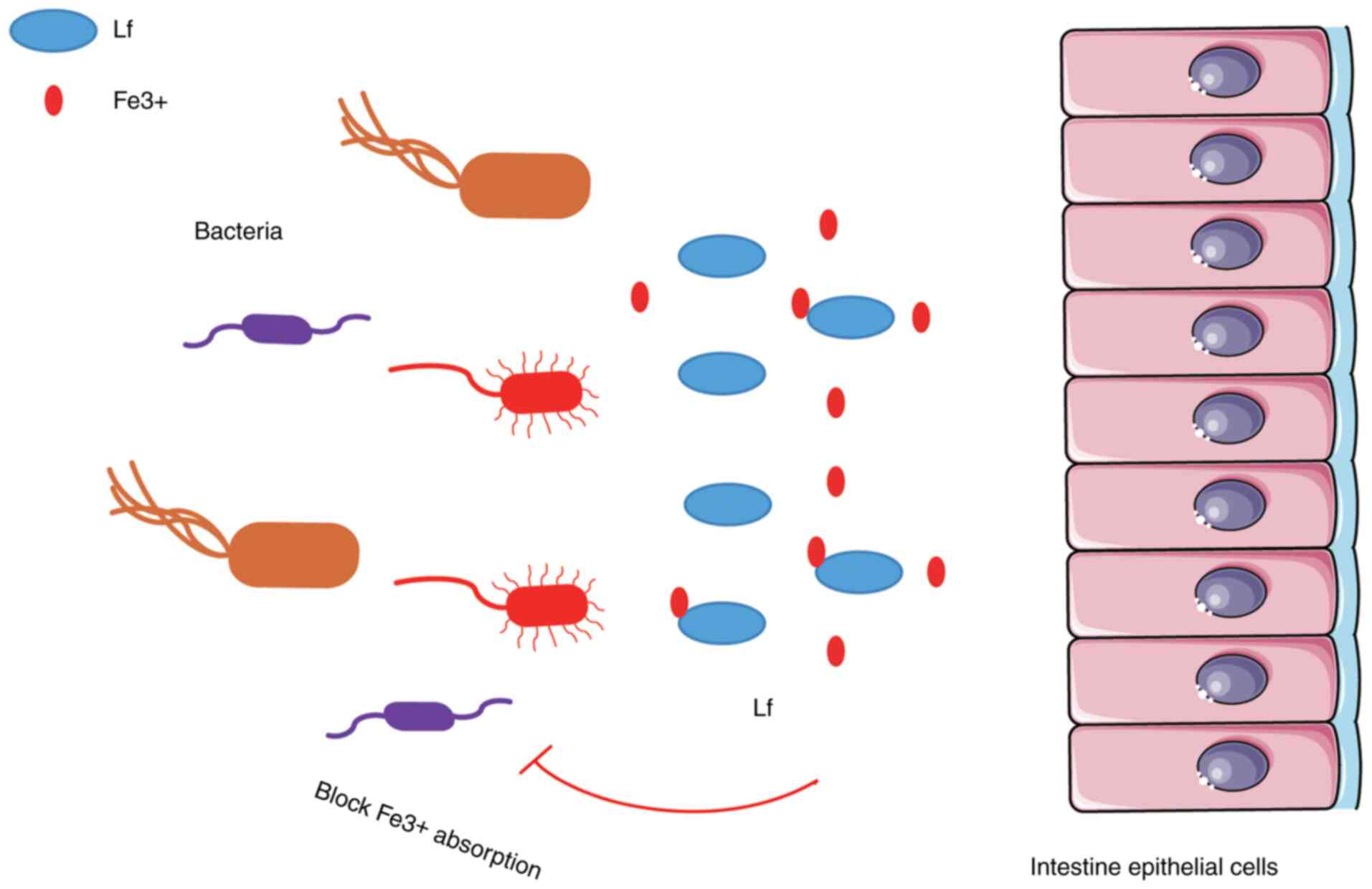 |
Рисунок 3ЛФ человека и крупного рогатого скота обладает широким спектром противомикробного действия в отношении грамположительных и грамотрицательных бактерий, грибков и ряда вирусов. ЛФ взаимодействует с поверхностью бактерий, подавляя поглощение бактериями Fe3+. Бактерицидный эффект ЛФ в основном опосредован его взаимодействием с бактериальной поверхностью. Исследования in vivo и in vitro показали, что ЛФ препятствует прикреплению определенных бактерий к клеткам-хозяевам. Лф, лактоферрин. |
ЛФ разрушает внешнюю мембрану грамотрицательных бактерий, взаимодействуя с ЛПС. Положительно заряженный n-конец ЛФ предотвращает взаимодействие ЛПС и бактериальных катионов (Ca 2+ и Mg 2+ ), что приводит к высвобождению ЛПС из клеточной стенки, увеличению проницаемости мембраны и последующему повреждению бактерий. Взаимодействие между ЛФ и ЛПС также усиливает действие природных антибактериальных средств, таких как лизоцим, которые в высоких концентрациях секретируются слизистой оболочкой вместе с ЛФ через ГЭБ (15) .). Исследования в диализной камере показывают, что уничтожение бактерий требует прямого контакта с ЛФ, а работа с очищенным ЛПС предполагает, что это связано с прямым связыванием ЛПС белком. Поскольку ЛФ и лизоцим присутствуют в секрете слизистой оболочки и гранулах нейтрофилов, их взаимодействие может способствовать защите хозяина ( 80 ).
Способность Helicobacter pylori использовать чЛФ в качестве источника железа зависит от контакта между клетками и белками. Поскольку в образцах резекции желудка у пациентов с поверхностным или атрофическим гастритом много ЛФ, поглощение железа H. pylori через специфические рецепторы hLf может играть главную роль в вирулентности инфекции H. pylori ( рис. 4 ) ( 81 ). Комбинация бычьего Lf и поверхностного белка Streptococcus pneumoniae неудовлетворительна, а человеческий трансферрин не связывается с поверхностным белком S. pneumoniae ( 82 ). ЛФ грудного молока инактивирует два предполагаемых фактора колонизации, экспрессируемых Haemophilus influenzae.. ЛФ в грудном молоке может снижать патогенный потенциал H. influenzae за счет селективной инактивации iga1-протеазы и hap, тем самым препятствуя колонизации бактерий ( 83 ).
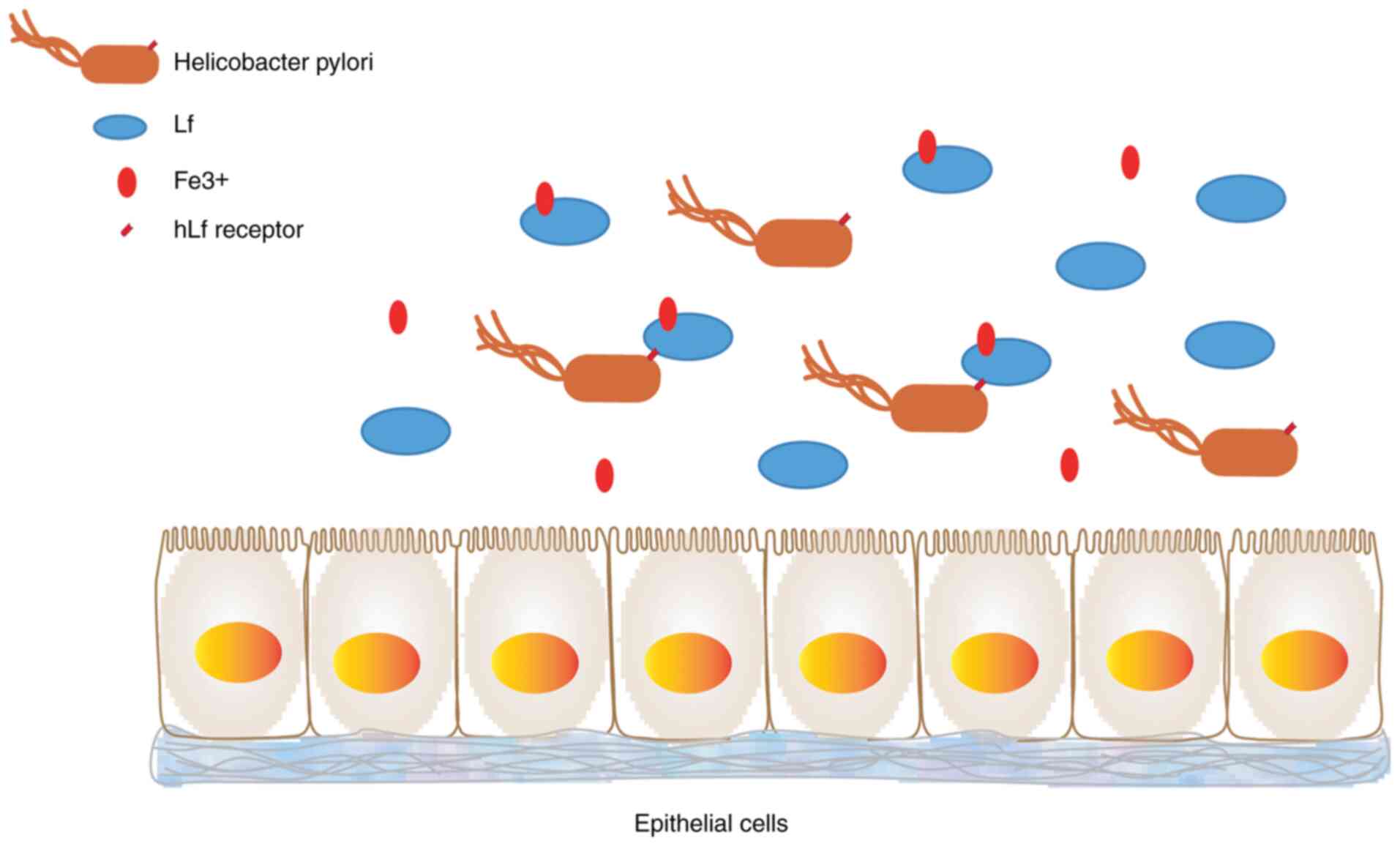 |
Рисунок 4Способность Helicobacter pylori использовать чЛФ в качестве источника железа зависит от контакта между клетками и белком. Поскольку значительное количество лактоферрина было зарегистрировано в образцах резекции желудка человека у пациентов с атрофическим гастритом, поглощение железа H. pylori через специфический рецептор hLf может играть решающую роль в вирулентности инфекции H. pylori. hLf, человеческий лактоферрин. |
ЛФ оказывает широкий ингибирующий эффект на ДНК- и РНК-содержащие вирусы.
ЛФ представляет собой железосвязывающий гликопротеин, обнаруживаемый в выделениях некоторых слизистых оболочек и обладающий противовирусной активностью в отношении ДНК- и РНК-вирусов, таких как ВИЧ и ротавирус. Противовирусный эффект ЛФ проявляется на ранних стадиях инфекции. ЛФ предотвращает проникновение вируса в клетку-хозяина, блокируя клеточные рецепторы ( 84 ). В частности, ЛФ обладает противовирусными и иммунными реакциями, например, продемонстрированными ЛФ против SARS-CoV, который тесно связан с SARS-CoV-2, вызывающим COVID-19 (85 ) .
ЛФ может предотвращать проникновение некоторых вирусов в клетки-хозяева, таких как полиовирус типа 1, вызывающий полиомиелит человека, вирусы простого герпеса типов I и II и гигантоклеточные вирусы. Для других вирусов, таких как вирус гепатита С (HCV) и ротавирус, вместо предотвращения их проникновения Lf ингибирует репликацию вируса в клетке-хозяине. В настоящее время специфический механизм торможения еще предстоит изучить; однако широко распространенной гипотезой является связывание и блокирование гликозаминогликановых рецепторов вируса, особенно гепарансульфата (HS), Lf. Комбинация LF и HS останавливает первый контакт между хозяином и вирусными клетками, тем самым предотвращая заражение. В пробиркеисследования показали, что в человеческой плазме и молочных белках LF оказывает сильное действие на ВИЧ, и этот эффект обусловлен ингибированием репликации вируса в клетках-хозяевах ( 15 ). Белок оболочки HCV связывается с Lf. hLf и bLf, многофункциональный иммуномодулятор, объединяет два белка оболочки ВГС. На основании вестерн-блоттинга молока , разделенного электрофорезом в полиакриламидном геле с лаурилсульфатом натрия или иммуноочисткой, бактерии, экспрессирующие e1 и e2, могут связываться с Lf ( 86-88 ) .
6. ЛФ имеет функции ферментативной активности
Действие ЛФ на грамположительные бактерии в основном основано на соединении катионов на поверхности ЛФ и анионов на поверхности бактерий, тем самым нейтрализуя отрицательные заряды на поверхности грамположительных бактерий. Например, липотейхоевая кислота уменьшает отрицательный заряд на клеточной стенке, тем самым облегчая контакт между лизоцимом и пептидогликаном под клеточной стенкой, в конечном итоге оказывая ферментативный эффект (15 ) .
ЛФ действует как фермент в определенных реакциях. Лф – молочный белок с наивысшей активностью ДНКазы, РНКазы, АТФазы и амилазы. Однако эта активность не является единственной ферментативной активностью Lf. bLf связывает два белка оболочки HCV ( 88 ). Lf обладает ДНК-связывающими свойствами ( 89 ) и может участвовать в активации транскрипции специфических последовательностей ДНК ( 90 ) или в качестве медиатора передачи сигнала ( 91 ). Целиакия имеет самую высокую активность амилазы и АТФ ( 92 ). Открытие свойств фермента Лф помогает выяснить ряд его физиологических функций.
7. ЛФ играет важную роль в нанотехнологиях
ЛФ используется в качестве наноносителя DOX, так как его рецептор в высокой степени экспрессируется на поверхности быстро пролиферирующих клеток (таких как раковые клетки). DOX является эффективным цитотоксическим противоопухолевым препаратом, но, как сообщается, он проявляет обширную токсичность для сердца и селезенки в дополнение к его ограниченной пероральной абсорбции ( 93 , 94 ). Нагруженные лекарственными препаратами препараты показали хорошую физическую стабильность, что указывает на незначительное повреждение мембраны эритроцитов. Доставка лекарств с помощью наноформ не только сводит к минимуму кардиотоксичность DOX, но также целенаправленно повышает эффективность и биодоступность препарата ( 95 ).
Исследование также показало, что наночастицы ЛФ используются для инкапсулирования противовирусных препаратов. Нанокапсулирование зидовудина в наночастицы ЛФ было достигнуто с помощью химии золь-масло. Зидовудин — эффективный противовирусный препарат с хорошей биодоступностью (50-75%); однако он может вызывать угнетение функции костного мозга, нейтропению и органную токсичность. В исследовании Кумара и др. ( 96), размер полученных наночастиц составлял 50-60 нм, эффективность инкапсуляции лекарственного средства составляла 67%, наблюдалась хорошая физическая стабильность при комнатной температуре и при 4°С. Кроме того, не было значительных изменений в размере частиц или содержании лекарственного средства. Пероральное введение наночастиц ЛФ, нагруженных эфавирензом, приводило к анти-ВИЧ-1 эффектам, сравнимым с эффектами свободного препарата. Кроме того, по сравнению со свободным эфавиренцем, наночастицы, содержащие лекарство, показали улучшенные фармакокинетические характеристики и меньшую органную токсичность, что указывает на то, что этот нанопрепарат является безопасной наноплатформой, которая может улучшить доставку лекарственного средства ( 96 ).
The cationic nature of Lf can be used to form complexes with negatively charged DNA through electrostatic complexation. In this context, in a previous study, plasmid pGFPC1, which encodes the green fluorescent protein, was used as a cargo gene (97). Lf nanoparticles loaded with plasmids were prepared using the sol-oil method. The diameter of the prepared Lf nanoparticles was 60 nm and the PDI was low, indicating the uniformity of the preparation. The prepared Lf nanoparticles also showed enhanced physical stability at a temperature of 4°C for ≤10 weeks without the particle size exhibiting significant changes. Incubation in DMEM containing 10% serum at 37°C for 8 h also did not result in changes to the particle size, which would result in longer plasma levels. This improved stability may be related to the strong electrostatic interactions between the positively charged Lf and negatively charged DNA. According to reports, Lf has a DNA-binding domain, which may help to further promote DNA binding and the formation of a tighter DNA-Lf nanocomplex (98).
Методы, используемые для получения наночастиц ЛФ, включают методы связывания наночастиц с альбумином (NAB) и методы термической денатурации. Технология NAB в первую очередь зависит от наличия маслянистой фазы, которую медленно добавляют к водной фазе, содержащей Lf. Как наночастица, Lf образует гель при термической обработке, ионной силе или изменении рН. Как правило, термическое гелеобразование белка начинается со стадии нагревания для денатурации белка с последующим добавлением соли для индукции агрегации белка ( 87 ).
ЛФ может участвовать в производстве полиэлектролитных комплексных наноносителей. Синтез таких наноносителей основан на использовании двух противоположно заряженных молекул, таких как положительно заряженный белок и отрицательно заряженный природный полисахарид. Наноносители на основе полиэлектролитных комплексов, вероятно, стабилизируются за счет сильных электростатических взаимодействий между катионными белками и анионными полисахаридами. Эта стабилизация также может повысить стабильность инкапсулированных активных ингредиентов ( 99 ). В таблице II приведены репрезентативные примеры наноносителей на основе ЛФ для приложений доставки лекарств.
Таблица IIНаноносители на основе ЛФ для доставки лекарств. |
8. Заключение и перспективы
В этом обзоре представлен подробный обзор биологических характеристик ЛФ, включая структуру биомолекул ЛФ, его сродство связывания с железом и взаимодействие между ЛФ и хозяином. ЛФ играет важную роль в регуляции иммунного ответа и обладает иммуностимулирующей, иммунной активацией, противовоспалительной активностью, антибактериальным, противовирусным действием и, в частности, противораковой активностью. На основании результатов нескольких исследований известно, что наноносители на основе ЛФ могут быть легко получены простыми методами и обладают отличным потенциалом активного нацеливания на опухолевые ткани, в частности опухоли головного мозга. Производство наноносителей на основе ЛФ может значительно повысить терапевтический потенциал инкапсулированных активных молекул.
Наличие данных и материалов
Непригодный.
Вклад авторов
HW, YG, XZ, GH, LL и SP собрали соответствующие бумаги и завершили рукопись и рисунки. YG и XZ предоставили конструктивные рекомендации и внесли критические изменения. XY, SW, TZ, HW и SP участвовали в разработке этого обзора. Все авторы прочитали и одобрили окончательный вариант рукописи. Аутентификация данных не применяется.
Этическое одобрение и согласие на участие
Непригодный.
Согласие пациента на публикацию
Непригодный.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Непригодный.
Сокращения:
|
Лф |
лактоферрин |
|
ЛПС |
липополисахарид |
|
ВГС |
вирус гепатита С |
|
ГС |
гепарансульфат |
|
CDK |
циклинзависимые киназы |
|
и т. д. |
природный убийца |
Рекомендации
|
Rascon-Cruz Q, Espinoza-Sanchez EA, Siqueiros-Cendon TS, Nakamura-Bencomo SI, Arévalo-Gallegos S and Iglesias-Figueroa BF: Lactoferrin: A glycoprotein involved in immunomodulation, anticancer, and antimicrobial processes. Molecules. 26:2052021. View Article : Google Scholar |
|
|
Baker EN, Baker HM and Kidd RD: Lactoferrin and transferrin: Functional variations on a common structural framework. Biochem Cell Biol. 80:27–34. 2002. View Article : Google Scholar |
|
|
Lambert LA, Perri H and Meehan TJ: Evolution of duplications in the transferrin family of proteins. Comp Biochem Physiol B Biochem Mol Biol. 140:11–25. 2005. View Article : Google Scholar |
|
|
Pierce A, Legrand D and Mazurier J: Lactoferrin: A multifunctional protein. Med Sci (Paris). 25:361–369. 2009.In French. View Article : Google Scholar |
|
|
Hao L, Shan Q, Wei J, Ma F and Sun P: Lactoferrin: Major physiological functions and applications. Curr Protein Pept Sci. 20:139–144. 2019. View Article : Google Scholar |
|
|
Garcia-Montoya IA, Cendon TS, Arevalo-Gallegos S and Rascon-Cruz Q: Lactoferrin a multiple bioactive protein: An overview. Biochim Biophys Acta. 1820:226–236. 2012. View Article : Google Scholar |
|
|
Легран Д., Пирс А., Эласс Э., Карпентье М., Мариллер С. и Мазурье Дж.: Структура и функции лактоферрина. Adv Exp Med Biol. 606: 163–194. 2008. Просмотр статьи : Google Scholar |
|
|
Янаихара А., Тома Ю., Сайто Х. и Янаихара Т.: Эффект лактоферрина на пролиферацию клеток в клетках стромы эндометрия человека. Мол Хум Репрод. 6: 469–473. 2000. Просмотр статьи : Google Scholar |
|
|
Huang N, Bethell D, Card C, Cornish J, Marchbank T, Wyatt D, Mabery K и Playford R: Биологически активный рекомбинантный человеческий лактоферрин, полученный из риса, стимулирует рост клеток млекопитающих. In Vitro Cell Dev Biol Anim. 44:464–471. 2008. Просмотр статьи : Google Scholar |
|
|
Siebert PD и Huang BC: Идентификация альтернативной формы мРНК лактоферрина человека, которая по-разному экспрессируется в нормальных тканях и опухолевых клеточных линиях. Proc Natl Acad Sci USA. 94:2198–2203. 1997. Просмотр статьи : Google Scholar |
|
|
Клейн Г., Имре С. и Забаровский Э.Р.: Почему не все мы умираем от рака в раннем возрасте? Adv Рак Res. 98:1–16. 2007. Просмотр статьи : Google Scholar |
|
|
Mariller C, Hardiville S, Hoedt E, Huvent I, Pina-Canseco S и Pierce A: Дельта-лактоферрин, внутриклеточная изоформа лактоферрина, которая действует как фактор транскрипции. Биохим Клеточная Биол. 90:307–319. 2012. Просмотр статьи : Google Scholar |
|
|
Tsuda H, Ohshima Y, Nomoto H, Fujita K, Matsuda E, Iigo M, Takasuka N и Moore MA: Профилактика рака с помощью натуральных соединений. Препарат Метаб Фармакокинет. 19: 245–263. 2004. Просмотр статьи : Google Scholar |
|
|
Guedes JP, Pereira CS, Rodrigues LR и Corte-Real M: Лактоферрин из коровьего молока избирательно убивает клетки высокометастатического рака предстательной железы PC-3 и остеосаркомы MG-63 in vitro. Фронт Онкол. 8:2002018. Просмотр статьи : Академия Google |
|
|
Гонсалес-Чавес С.А., Аревало-Гальегос С. и Раскон-Крус В.: Лактоферрин: структура, функция и применение. Противомикробные агенты Int J. 33:301.e1–e8. 2009. Просмотр статьи : Google Scholar |
|
|
Актер Дж.К., Хванг С.А. и Крузель М.Л.: Лактоферрин как естественный иммуномодулятор. Курр Фарм Дез. 15:1956–1973. 2009. Просмотр статьи : Google Scholar |
|
|
Яблочное молоко BJ, An YQ, Geerts M, Thijs BG, de Boer HA, MacLaren DM, de Graaff J и Nuijens JH: Лактоферрин представляет собой белок, связывающий липид А. Заразить иммун. 62:2628–2632. 1994. Просмотр статьи : Google Scholar |
|
|
Эласс-Рошард Э., Розану А., Легран Д., Триф М., Салмон В., Мотас С., Монтрей Дж. и Спик Г. Взаимодействие лактоферрина с липополисахаридом: участие 28-34-петлевой области лактоферрина человека в высокоаффинном связывании с Escherichia coli 055B5 липополисахарид. Биохим Дж. 312:839–845. 1995. Просмотр статьи : Google Scholar |
|
|
Hu P, Zhao F, Wang J и Zhu W: Лактоферрин ослабляет липополисахарид-стимулированные воспалительные реакции и нарушение барьера посредством модуляции путей NF-kappaB/MAPK/Nrf2 в клетках IPEC-J2. Функция питания 11:8516–8526. 2020. Просмотр статьи : Google Scholar |
|
|
Baker HM и Baker EN: Структурный взгляд на функцию лактоферрина. Биохим Клеточная Биол. 90:320–328. 2012. Просмотр статьи : Google Scholar |
|
|
Cools-Lartigue J, Spicer J, McDonald B, Gowing S, Chow S, Giannias B, Bourdeau F, Kubes P и Ferri L: Нейтрофильные внеклеточные ловушки изолируют циркулирующие опухолевые клетки и способствуют метастазированию. Джей Клин Инвест. 123:3446–3458. 2013. Просмотр статьи : Google Scholar |
|
|
van der Does AM, Hensbergen PJ, Bogaards SJ, Cansoy M, Deelder AM, van Leeuwen HC, Drijfhout JW, van Disssel JT и Nibbering PH: человеческий пептид hLF1-11, полученный из лактоферрина, оказывает иммуномодулирующее действие путем специфического ингибирования активности миелопероксидазы. Дж Иммунол. 188: 5012–5019. 2012. Просмотр статьи : Google Scholar |
|
|
Park HW, Park SH, Jo HJ, Kim TG, Lee JH, Kang SG, Jang YS и Kim PH: Лактоферрин индуцирует толерогенные дендритные клетки костного мозга. Иммунная сеть. 20:e382020. Просмотр статьи : Академия Google |
|
|
Eipper S, Steiner R, Lesner A, Sienczyk M, Palesch D, Halatsch ME, Zaczynska E, Heim C, Hartmann MD, Zimecki M и др.: Лактоферрин является аллостерическим усилителем протеолитической активности катепсина G. PLoS One. 11:e1515092016. Просмотр статьи : Академия Google |
|
|
Penco S, Scarfi S, Giovine M, Damonte G, Millo E, Villaggio B, Passalacqua M, Pozzolini M, Garrè C и Benatti U: Идентификация импортного сигнала и ядерная локализация лактоферрина человека. Биотехнология Appl Biochem. 34:151–159. 2001. Просмотр статьи : Google Scholar |
|
|
Vogel HJ: Лактоферрин, вид с высоты птичьего полета. Биохим Клеточная Биол. 90:233–244. 2012. Просмотр статьи : Google Scholar |
|
|
Такаяма И. и Аоки Р.: Роль лактоферрина в заживлении кожных ран. Биохим Клеточная Биол. 90: 497–503. 2012. Просмотр статьи : Google Scholar |
|
|
Кабанов А.В., Батракова Е.В.: Новые технологии доставки лекарств через гематоэнцефалический барьер. Курр Фарм Дез. 10:1355–1363. 2004. Просмотр статьи : Google Scholar |
|
|
Эльзогби А.О., Абдельмоним М.А., Хассанин И.А., Абд Эльвакил М.М., Эльнаггар М.А., Мохтар С., Фанг Дж.Ю. и Эльходаири К.А.: Лактоферрин, многофункциональный гликопротеин: активный терапевтический, наноноситель лекарственного средства и нацеливающий лиганд. Биоматериалы. 263:1203552020. Просмотр статьи : Академия Google |
|
|
Тангавел П., Рамачандран Б., Чакраборти С., Каннан Р., Лончин С. и Мутувиджаян В.: Ускоренное заживление диабетических ран, обработанных гидрогелями, содержащими L-глутаминовую кислоту, за счет усиленного отложения коллагена и ангиогенеза: исследование in vivo. Научный отчет 7:107012017. Просмотр статьи : Академия Google |
|
|
Ииго М., Александр Д.Б., Лонг Н., Сюй Дж., Фукамачи К., Футакучи М., Такасе М. и Цуда Х.: Пути антиканцерогенеза, активируемые бычьим лактоферрином в тонкой кишке мышей. Биохимия. 91:86–101. 2009. Просмотр статьи : Google Scholar |
|
|
Xu XX, Jiang HR, Li HB, Zhang TN, Zhou Q and Liu N: Apoptosis of stomach cancer cell SGC-7901 and regulation of Akt signaling way induced by bovine lactoferrin. J Dairy Sci. 93:2344–2350. 2010. View Article : Google Scholar |
|
|
Wong SH, Francis N, Chahal H, Raza K, Salmon M, Scheel-Toellner D and Lord JM: Lactoferrin is a survival factor for neutrophils in rheumatoid synovial fluid. Rheumatology (Oxford). 48:39–44. 2009. View Article : Google Scholar |
|
|
Kruzel ML, Zimecki M and Actor JK: Lactoferrin in a context of inflammation-induced pathology. Front Immunol. 8:14382017. View Article : Google Scholar |
|
|
Bournazou I, Pound JD, Duffin R, Bournazos S, Melville LA, Brown SB, Rossi AG and Gregory CD: Apoptotic human cells inhibit migration of granulocytes via release of lactoferrin. J Clin Invest. 119:20–32. 2009. |
|
|
Bezault J, Bhimani R, Wiprovnick J and Furmanski P: Human lactoferrin inhibits growth of solid tumors and development of experimental metastases in mice. Cancer Res. 54:2310–2312. 1994.PubMed/NCBI |
|
|
Damiens E, Mazurier J, el Yazidi I, Masson M, Duthille I, Spik G and Boilly-Marer Y: Effects of human lactoferrin on NK cell cytotoxicity against haematopoietic and epithelial tumour cells. Biochim Biophys Acta. 1402:277–287. 1998. View Article : Google Scholar |
|
|
Shi H and Li W: Inhibitory effects of human lactoferrin on U14 cervical carcinoma through upregulation of the immune response. Oncol Lett. 7:820–826. 2014. View Article : Google Scholar |
|
|
Iyer S, Yip TT, Hutchens TW and Lonnerdal B: Lactoferrin-receptor interaction. Effect of surface exposed histidine residues. Adv Exp Med Biol. 357:245–252. 1994. View Article : Google Scholar |
|
|
Rastogi N, Singh A, Pandey SN, Sinha M, Bhushan A, Kaur P, Sharma S and Singh TP: Structure of the iron-free true C-terminal half of bovine lactoferrin produced by tryptic digestion and its functional significance in the gut. FEBS J. 281:2871–2882. 2014. View Article : Google Scholar |
|
|
Teng CT: Factors regulating lactoferrin gene expression. Biochem Cell Biol. 84:263–267. 2006. View Article : Google Scholar |
|
|
Ieni A, Barresi V, Licata L, Cardia R, Fazzari C, Nuciforo G, Caruso F, Caruso M, Adamo V and Tuccari G: Immunoexpression of lactoferrin in triple-negative breast cancer patients: A proposal to select a less aggressive subgroup. Oncol Lett. 13:3205–3209. 2017. View Article : Google Scholar |
|
|
Tsuda H, Kozu T, Iinuma G, Ohashi Y, Saito Y, Saito D, Akasu T, Alexander DB, Futakuchi M, Fukamachi K, et al: Cancer prevention by bovine lactoferrin: From animal studies to human trial. Biometals. 23:399–409. 2010. View Article : Google Scholar |
|
|
Gibbons JA, Kanwar RK and Kanwar JR: Lactoferrin and cancer in different cancer models. Front Biosci (Schol Ed). 3:1080–1088. 2011. View Article : Google Scholar |
|
|
Digumarti R, Wang Y, Raman G, Doval DC, Advani SH, Julka PK, Parikh PM, Patil S, Nag S, Madhavan J, et al: A randomized, double-blind, placebo-controlled, phase II study of oral talactoferrin in combination with carboplatin and paclitaxel in previously untreated locally advanced or metastatic non-small cell lung cancer. J Thorac Oncol. 6:1098–1103. 2011. View Article : Google Scholar |
|
|
Hoedt E, Hardiville S, Mariller C, Elass E, Perraudin JP and Pierce A: Discrimination and evaluation of lactoferrin and delta-lactoferrin gene expression levels in cancer cells and under inflammatory stimuli using TaqMan real-time PCR. Biometals. 23:441–452. 2010. View Article : Google Scholar |
|
|
Zadvornyi TV, Lukianova NY, Borikun TV and Chekhun VF: Effects of exogenous lactoferrin on phenotypic profile and invasiveness of human prostate cancer cells (DU145 and LNCaP) in vitro. Exp Oncol. 40:184–189. 2018. View Article : Google Scholar |
|
|
Cutone A, Ianiro G, Lepanto MS, Rosa L, Valenti P, Bonaccorsi di Patti MC and Musci G: Lactoferrin in the prevention and treatment of intestinal inflammatory pathologies associated with colorectal cancer development. Cancers (Basel). 12:38062020. View Article : Google Scholar |
|
|
Duchardt F, Ruttekolk IR, Verdurmen WP, Lortat-Jacob H, Bürck J, Hufnagel H, Fischer R, van den Heuvel M, Löwik DW, Vuister GW, et al: A cell-penetrating peptide derived from human lactoferrin with conformation-dependent uptake efficiency. J biol Chem. 284:36099–36108. 2009. View Article : Google Scholar |
|
|
Riedl S, Leber R, Rinner B, Schaider H, Lohner K and Zweytick D: Human lactoferricin derived di-peptides deploying loop structures induce apoptosis specifically in cancer cells through targeting membranous phosphatidylserine. Biochim Biophys Acta. 1848:2918–2931. 2015. View Article : Google Scholar |
|
|
Kühnle A, Veelken R, Galuska CE, Saftenberger M, Verleih M, Schuppe HC, Rudloff S, Kunz C and Galuska SP: Polysialic acid interacts with lactoferrin and supports its activity to inhibit the release of neutrophil extracellular traps. Carbohydr Polym. 208:32–41. 2019. View Article : Google Scholar |
|
|
El YI, Legrand D, Nuijens J, Slomianny MC, van Berkel P и Spik G: Связывание лактоферрина с гликозаминогликанами на энтероцитоподобных клетках HT29-18-C1 опосредуется основными остатками, расположенными на N-конце. Биохим Биофиз Акта. 1568: 197–204. 2001. Просмотр статьи : Google Scholar |
|
|
Цзян Р. и Лённердал Б.: Бычий лактоферрин и лактоферрицин оказывают противоопухолевое действие на клетки колоректального рака человека (HT-29), активируя различные сигнальные пути. Биохим Клеточная Биол. 95:99–109. 2017. Просмотр статьи : Google Scholar |
|
|
Шарма А., Шандиля Великобритания, Содхи М., Моханти А.К., Джайн П. и Мукеш М.: Оценка лактоферрина, полученного из молозива коров сахивал (Bos indicus) и каран фри (кроссбред) на его противораковый потенциал. Int J Mol Sci. 20:63182019. Просмотр статьи : Академия Google |
|
|
Ариас М., Хилчи А.Л., Хейни Э.Ф., Большер Дж.Г., Хайндман М.Е., Хэнкок Р.Е. и Фогель Х.Дж.: Противораковая активность пептидов, полученных из лактоферрицина крупного рогатого скота и человека. Биохим Клеточная Биол. 95:91–98. 2017. Просмотр статьи : Google Scholar |
|
|
Zhou Y, Zeng Z, Zhang W, Xiong W, Wu M, Tan Y, Yi W, Xiao L, Li X, Huang C и др.: Лактотрансферрин: кандидат в опухолевые супрессоры — Дефицит экспрессии при карциноме носоглотки человека и ингибирование NPC клеточной пролиферации путем модулирования митоген-активируемого протеинкиназного пути. INT J Рак. 123:2065–2072. 2008. Просмотр статьи : Google Scholar |
|
|
Onishi J, Roy MK, Juneja LR, Watanabe Y и Tamai Y: Производный лактоферрина пептид с катионными остатками, сконцентрированными в области его спиральной структуры, вызывает некротическую гибель клеток в лейкемической клеточной линии (HL-60). J Pept Sci. 14:1032–1038. 2008. Просмотр статьи : Google Scholar |
|
|
Lee SH, Park SW, Pyo CW, Yoo NK, Kim J и Choi SY: Требование JNK-ассоциированного пути Bcl-2 для индуцированного лактоферрином человека апоптоза в линии Т-клеток лейкемии Jurkat. Биохимия. 91:102–108. 2009. Просмотр статьи : Google Scholar |
|
|
Fujita K, Matsuda E, Sekine K, Iigo M и Tsuda H: Лактоферрин усиливает экспрессию Fas и апоптоз в слизистой оболочке толстой кишки крыс, получавших азоксиметан. Канцерогенез. 25:1961–1966. 2004. Просмотр статьи : Google Scholar |
|
|
Гопал С.Х. и Дас С.К.: Роль лактоферрина в канцерогенезе тройного негативного рака молочной железы. Испытания J Cancer Clin. 1:e1052016. |
|
|
Веллиягоундер К., Бахдила Д., Павар С. и Файн Д.Х.: Роль лактоферрина и пептидов, полученных из лактоферрина, при заболеваниях полости рта и челюстно-лицевой области. Оральный Дис. 25:652–669. 2019. Просмотр статьи : Google Scholar |
|
|
Damiens E, El YI, Mazurier J, Duthille I, Spik G и Boilly-Marer Y: Лактоферрин ингибирует циклин-зависимые киназы G1 во время остановки роста клеток карциномы молочной железы человека. Джей Селл Биохим. 74:486–498. 1999. Просмотр статьи : Google Scholar |
|
|
Ибрагим Х.М., Мохамед А.Х., Салем М.Л., Осман Г.Ю. и Морси Д.С.: Противоопухолевый и иммуномодулирующий потенциал совместного лечения на основе бычьего лактоферрина и/или мурамилдипептида у мышей с опухолями. Токсикол Рез (Кэмб). 9: 137–147. 2020. Просмотр статьи : Google Scholar |
|
|
Сангермано Р., Пернарелла С., Стракер М., Лепанто М.С., Роза Л., Кутоне А., Валенти П. и Оттоленги Л.: Лечение черного пятна, связанного с нарушениями метаболизма железа, с помощью лактоферрина: поиск литературы и два тематических исследования. Клин Тер. 170:e373–e381. 2019. ПабМед/NCBI |
|
|
Li HY, Li M, Luo CC, Wang JQ и Zheng N: Лактоферрин оказывает противоопухолевое действие, ингибируя ангиогенез в модели опухоли толстой кишки человека HT29. J Agric Food Chem. 65:10464–10472. 2017. Просмотр статьи : Google Scholar |
|
|
Таммам С.Н., Аззази Х. и Лампрехт А. Ядерная и цитоплазматическая доставка лактоферрина при глиоме с использованием наночастиц хитозана: действие лактоферрина в зависимости от расположения в клетке. Евр Джей Фарм Биофарм. 129:74–79. 2018. Просмотр статьи : Google Scholar |
|
|
Голла К., Бхаскар С., Ахмед Ф. и Кондапи А.К.: Целенаправленный пероральный состав белковых наночастиц доксорубицина: эффективность и безопасность при гепатоцеллюлярном раке. Дж Рак. 4: 644–652. 2013. Просмотр статьи : Google Scholar |
|
|
Sabra S и Agwa MM: Лактоферрин, уникальная молекула с разнообразными терапевтическими и нанотехнологическими применениями. Int J Биол Макромоль. 164: 1046–1060. 2020. Просмотр статьи : Google Scholar |
|
|
Song MM, Xu HL, Liang JX, Xiang HH, Liu R и Shen YX: Лактоферрин модифицированный нанокомпозит на основе оксида графена и оксида железа для доставки лекарств, нацеленных на глиому. Mater Sci Eng C Mater Biol Appl. 77:904–911. 2017. Просмотр статьи : Google Scholar |
|
|
Томитака А., Арами Х., Ганди С. и Кришнан К.М.: Наночастицы оксида железа, конъюгированные с лактоферрином, для нацеливания на клетки глиомы головного мозга при визуализации с помощью магнитных частиц. Наномасштаб. 7:16890–16898. 2015. Просмотр статьи : Google Scholar |
|
|
Zhang M, Asghar S, Tian C, Hu Z, Ping Q, Chen Z, Shao F и Xiao Y: наногели гиалуроновой кислоты, функционализированные лактоферрином/фенилборной кислотой, загружающие гидрохлорид доксорубицина для нацеливания на глиому. Карбогидр Полим. 253:1171942021. Просмотр статьи : Академия Google |
|
|
Yin Y, Fu C, Li M, Li X, Wang M, He L, Zhang LM и Peng Y: рН-чувствительный пролекарство гиалуроновой кислоты, модифицированное лактоферрином, для двунаправленного лечения глиомы. Mater Sci Eng C Mater Biol Appl. 67:159–169. 2016. Просмотр статьи : Google Scholar |
|
|
Guan Q: всесторонний обзор и обновленная информация о патогенезе воспалительного заболевания кишечника. Дж. Иммунол Рез. 2019:72472382019. Просмотр статьи : Академия Google |
|
|
Frioni A, Conte MP, Cutone A, Longhi C, Musci G, di Patti MC, Natalizi T, Marazzato M, Lepanto MS, Puddu P и др.: Лактоферрин по-разному модулирует воспалительную реакцию в эпителиальных моделях, имитирующих воспалительные и инфекционные заболевания человека. Биометаллы. 27:843–856. 2014. Просмотр статьи : Google Scholar |
|
|
Сесса Р., Ди Пьетро М., Филардо С., Брессан А., Роза Л., Кутоне А., Фриони А., Берлутти Ф., Паэсано Р. и Валенти П.: Влияние лактоферрина крупного рогатого скота на инфекцию и воспаление, вызываемые хламидией трахоматис. Биохим Клеточная Биол. 95:34–40. 2017. Просмотр статьи : Google Scholar |
|
|
Валенти П., Фриони А., Росси А., Рануччи С., Де Фино И., Кутоне А., Роза Л., Брагонзи А. и Берлутти Ф. Аэрозольный бычий лактоферрин снижает количество нейтрофилов и провоспалительных цитокинов в мышиных моделях легочных инфекций Pseudomonas aeruginosa. Биохим Клеточная Биол. 95:41–47. 2017. Просмотр статьи : Google Scholar |
|
|
Свендсен Дж., Грант Т.М., Реннисон Д., Бримбл М.А. и Свенсон Дж.: Очень короткие и стабильные противомикробные пептиды, производные лактоферрицина: принципы разработки и потенциальное использование. Acc Chem Res. 52:749–759. 2019. Просмотр статьи : Google Scholar |
|
|
Dial EJ, Romero JJ, Headon DR и Lichtenberger LM: Рекомбинантный человеческий лактоферрин эффективен при лечении мышей, инфицированных Helicobacter Felis. Дж Фарм Фармакол. 52:1541–1546. 2000. Просмотр статьи : Google Scholar |
|
|
Родригес-Франко Д.А., Васкес-Морено Л. и Рамос-Кламонт М.Г. Антимикробные механизмы и возможное клиническое применение лактоферрина. Преподобный Латиноам Микробиол. 47:102–111. 2005. На испанском языке. |
|
|
Эллисон Р.Р. и Гил Т.Дж.: Уничтожение грамотрицательных бактерий лактоферрином и лизоцимом. Джей Клин Инвест. 88:1080–1091. 1991. Просмотр статьи : Google Scholar |
|
|
Дэненс Л., Щебара Ф. и Хассон М.О.: Идентификация, характеристика и иммуногенность лактоферрин-связывающего белка Helicobacter pylori. Заразить иммун. 65: 514–518. 1997. Просмотр статьи : Google Scholar |
|
|
Kuipers ME, de Vries HG, Eikelboom MC, Meijer DK и Swart PJ: Синергетические фунгистатические эффекты лактоферрина в сочетании с противогрибковыми препаратами против клинических изолятов Candida. Противомикробные агенты Chemother. 43:2635–2641. 1999. Просмотр статьи : Google Scholar |
|
|
Hakansson A, Roche H, Mirza S, McDaniel LS, Brooks-Walter A и Briles DE: Характеристика связывания лактоферрина человека с пневмококковым поверхностным белком A. Infect Immun. 69:3372–3381. 2001. Просмотр статьи : Google Scholar |
|
|
Ван дер Страте Б.В., Бельяарс Л., Молема Г., Хармсен М.С. и Мейер Д.К.: Противовирусная активность лактоферрина. Противовирусный рез. 52:225–239. 2001. Просмотр статьи : Google Scholar |
|
|
Campione E, Cosio T, Rosa L, Lanna C, Di Girolamo S, Gaziano R, Valenti P и Bianchi L: Лактоферрин как защитный естественный барьер слизистой оболочки дыхательных путей и кишечника от коронавирусной инфекции и воспаления. Int J Mol Sci. 21:49032020. Просмотр статьи : Академия Google |
|
|
Келл Д.Б., Хейден Э.Л. и Преториус Э.: Биология лактоферрина, железосвязывающего белка, который помогает защищаться от вирусов и бактерий. Фронт Иммунол. 11:12212020. Просмотр статьи : Академия Google |
|
|
Fu Q, Sun J, Zhang W, Sui X, Yan Z и He Z: Технология наночастиц, связанных с альбумином (NAB), является многообещающим методом доставки противораковых препаратов. Недавний Пэт Противораковый препарат Discov. 4: 262–272. 2009. Просмотр статьи : Google Scholar |
|
|
Йи М., Канеко С., Ю Д.Ю. и Мураками С.: Белки оболочки вируса гепатита С связывают лактоферрин. Дж Вирол. 71:5997–6002. 1997. Просмотр статьи : Google Scholar |
|
|
Bennett RM, Merritt MM и Gabor G: Лактоферрин связывается с ДНК нейтрофильной мембраны. Бр Дж Гематол. 63:105–117. 1986. Просмотр статьи : Google Scholar |
|
|
He J и Furmanski P: Специфичность последовательности и активация транскрипции при связывании лактоферрина с ДНК. Природа. 373: 721–724. 1995. Просмотр статьи : Google Scholar |
|
|
Brandl N, Zemann A, Kaupe I, Marlovits S, Huettinger P, Goldenberg H и Huettinger M: передача сигналов и метаболизм в хондроцитах модулируются лактоферрином. Хрящевой остеоартрит. 18:117–125. 2010. Просмотр статьи : Google Scholar |
|
|
Kanyshkova TG, Babina SE, Semenov DV, Isaeva N, Vlassov AV, Neustroev KN, Kul'minskaya AA, Buneva VN and Nevinsky GA: Multiple enzymic activities of human milk lactoferrin. Eur J Biochem. 270:3353–3361. 2003. View Article : Google Scholar |
|
|
Fang JH, Lai YH, Chiu TL, Chen YY, Hu SH и Chen SY: Нанокапсулы с магнитным ядром и оболочкой с возможностью двойного нацеливания и совместной доставкой нескольких лекарств для лечения глиом головного мозга. Adv Healthc Mater. 3:1250–1260. 2014. Просмотр статьи : Google Scholar |
|
|
Wei M, Guo X, Tu L, Zou Q, Li Q, Tang C, Chen B, Xu Y и Wu C: Модифицированные лактоферрином пегилированные липосомы, нагруженные доксорубицином, для адресной доставки к гепатоцеллюлярной карциноме. Int J Наномедицина. 10: 5123–5137. 2015. ПабМед/NCBI. |
|
|
Голла К., Черукувада Б., Ахмед Ф. и Кондапи А.К.: Эффективность, безопасность и противораковая активность доставки доксорубицина на основе белковых наночастиц путем внутривенного введения крысам. ПЛОС Один. 7:e519602012. Просмотр статьи : Академия Google |
|
|
Кумар П., Лакшми Ю.С., К.Б., Голла К. и Кондапи А.К.: Повышение безопасности, биодоступности и фармакокинетики зидовудина за счет наночастиц лактоферрина при пероральном введении крысам. ПЛОС Один. 10:e1403992015. Просмотр статьи : Академия Google |
|
|
Кумари С. и Кондапи А.К.: Адресная доставка ДНК, опосредованная рецепторами, с использованием наночастиц лактоферрина. Int J Биол Макромоль. 108:401–407. 2018. Просмотр статьи : Google Scholar |
|
|
Эльфингер М., Маукш С. и Рудольф С.: Характеристика лактоферрина как нацеливающего лиганда для доставки невирусных генов в эпителиальные клетки дыхательных путей. Биоматериалы. 28:3448–3455. 2007. Просмотр статьи : Google Scholar |
|
|
Yan JK, Qiu WY, Wang YY и Wu JY: Биосовместимые полиэлектролитные комплексные наночастицы из лактоферрина и пектина в качестве потенциальных носителей антиоксидантного куркумина. J Agric Food Chem. 65:5720–5730. 2017. Просмотр статьи : Google Scholar |
|
|
Wang J, Li Q, Li K, Ou Y, Han Z, Gao D и Li J: Влияние аденовирусных векторов, опосредованных кДНК лактоферрина человека, на мышей с карциномой молочной железы EMT6. Аптека. 66: 704–709. 2011. |
|
|
Pereira CS, Guedes JP, Goncalves M, Loureiro L, Castro L, Gerós H, Rodrigues LR и Côrte-Real M: Лактоферрин избирательно запускает апоптоз в высокометастатических клетках рака молочной железы посредством ингибирования V-H+-АТФазы плазмалеммы. Онкотаргет. 7:62144–62158. 2016. Просмотр статьи : Google Scholar |
|
|
Lonnerdal B, Jiang R и Du X: Лактоферрин крупного рогатого скота может поглощаться человеческим кишечным рецептором лактоферрина и проявлять биологическую активность. J Pediatr Gastroenterol Nutr. 53:606–614. 2011. Просмотр статьи : Google Scholar |
|
|
Мачадо С., Алвес Р., Лима М., Леал И. и Масса А. Кожная некробиотическая ксантогранулема (NXG) успешно вылечена низкой дозой хлорамбуцила. Евр Дж Дерматол. 11: 458–462. 2001. ПабМед/NCBI. |
|
|
Арчелла А., Олива М.А., Стафьери С., Аалберти С., Гриллеа Г., Мадонна М., Бартоло М., Павоне Л., Джангасперо Ф., Канторе Г. и Фрати А. Влияние лактоферрина человека in vitro и in vivo на рост глиобластомы. Дж Нейрохирург. 123:1026–1035. 2015. Просмотр статьи : Google Scholar |
|
|
Son HJ, Lee SH и Choi SY: Лактоферрин человека контролирует уровень белка ретинобластомы и его активность. Биохим Клеточная Биол. 84:345–350. 2006. Просмотр статьи : Google Scholar |
|
|
Tung YT, Chen HL, Yen CC, Lee PY, Tsai HC, Lin MF и Chen CM: Лактоферрин крупного рогатого скота ингибирует рост рака легких посредством подавления как воспаления, так и экспрессии сосудистого эндотелиального фактора роста. Дж. Молочная наука. 96:2095–2106. 2013. Просмотр статьи : Google Scholar |
|
|
Deng M, Zhang W, Tang H, Ye Q, Liao Q, Zhou Y, Wu M, Xiong W, Zheng Y, Guo X и др.: Лактотрансферрин действует как супрессор опухоли при карциноме носоглотки, подавляя AKT с помощью нескольких механизмов. Онкоген. 32:4273–4283. 2013. Просмотр статьи : Google Scholar |
|
|
Chea C, Miyauchi M, Inubushi T, Febriyanti Ayuningtyas N, Subarnbhesaj A, Nguyen PT, Shrestha M, Haing S, Ohta K и Takata T: Молекулярный механизм ингибирующего действия бычьего лактоферрина на рост плоскоклеточной карциномы полости рта. ПЛОС Один. 13:e1916832018. Просмотр статьи : Академия Google |
|
|
Sabra SA, Elzoghby AO, Sheweita SA, Haroun M, Helmy MW, Eldemellawy MA, Xia Y, Goodale D, Allan AL и Rohani S: Самособирающиеся амфифильные мицеллы зеин-лактоферрин для направленной на опухоль совместной доставки рапамицина и вогонина в грудь рак. Евр Джей Фарм Биофарм. 128:156–169. 2018. Просмотр статьи : Google Scholar |
|
|
Sabra SA, Sheweita SA, Haroun M, Ragab D, Eldemellawy MA, Xia Y, Goodale D, Allan AL, Elzoghby AO и Rohani S: самособирающиеся белковые мицеллы с магнитным управлением для улучшенной доставки дазатиниба в клетки тройного негативного рака молочной железы человека . Дж. Фарм. 108: 1713–1725. 2019. Просмотр статьи : Google Scholar |
|
|
Abd Elwakil MM, Mabrouk MT, Helmy MW, Abdelfattah EA, Khiste SK, Elkhodairy KA и Elzoghby AO: Ингаляционные нанокомпозиты лактоферрин-хондроитин для комбинированной доставки доксорубицина и эллаговой кислоты к карциноме легких. Наномедицина (Лонд). 13:2015–2035. 2018. Просмотр статьи : Google Scholar |
|
|
Кумари С., Ахсан С.М., Кумар Дж.М., Кондапи А.К. и Рао Н.М.: Преодоление гематоэнцефалического барьера с помощью наночастиц лактоферрина двойного назначения темозоломида для борьбы с глиомой (SERP-17-12433). Научный отчет 7:66022017. Просмотр статьи : Академия Google |
|
|
Кумари С. и Кондапи А.К.: направленная доставка 5-фторурацила, опосредованная наночастицами лактоферрина, для повышения терапевтической эффективности. Int J Биол Макромоль. 95:232–237. 2017. Просмотр статьи : Google Scholar |
|
|
Wang H, Tang Y, Fang Y, Zhang M, Wang H, He Z, Wang B, Xu Q и Huang Y: перепрограммирование иммунной микросреды опухоли (TIME) и метаболизма с помощью биомиметического нацеливания на кодовую доставку Shikonin/JQ1. Нано Летт. 19: 2935–2944. 2019. Просмотр статьи : Google Scholar |
|
|
Кумар П., Лакшми Ю.С. и Кондапи А.К.: Пероральный состав наночастиц лактоферрина, нагруженных эфавиренцем, с улучшенным биораспределением и фармакокинетическим профилем. ВИЧ мед. 18:452–462. 2017. Просмотр статьи : Google Scholar |
|
|
Zhang ZH, Wang XP, Ayman WY, Munyendo WL, Lv HX и Zhou JP: Исследования наночастиц лактоферрина гамбогиновой кислоты для пероральной доставки. Наркотик Делив. 20:86–93. 2013. Просмотр статьи : Google Scholar |
|
|
Shankaranarayanan JS, Kanwar JR, Al-Juhaishi AJ и Kanwar RK: доксорубицин, конъюгированный с иммуномодулирующим противоопухолевым лактоферрином, проявляет улучшенную цитотоксичность, преодолевая химиорезистентность рака предстательной железы, и ингибирует развитие опухоли у мышей TRAMP. Научный отчет 6: 320622016. Просмотр статьи : Академия Google Статьи по Теме
|